第20回:酸化還元②「酸化数」
共有結合で結びついている原子の酸化数
前のページではイオンの酸化数を説明しましたが、次は、共有結合で結びついている原子の酸化数を説明します。例として、H2Oについて考えてみましょう。
H2OのH-O結合は共有結合ですから、イオン結合のように電子がどちらかの原子に移動しているということはありません。ですから、共有結合している原子の酸化数を考えるときは、イオンのときと同じ考え方はできません。
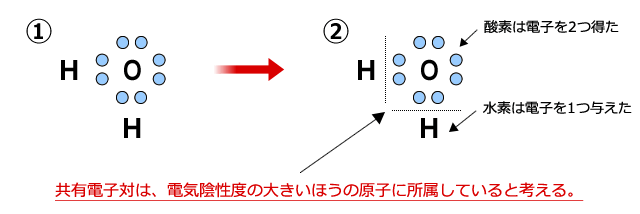
共有結合している原子の酸化数を考えるときは、まず、①のように電子式を書きます。
次に、共有電子対は、電気陰性度の大きなほうに完全に引き寄せられていると考えます。すると、②のようにHとOの共有電子対がOのものになっている図が書けます。わかりやすいように線を引いて、共有電子対がOに所属していることを明示しましょう。
すると、Hは電子を1つ失い、酸素は2つのHから1つずつ、合計2つの電子を得た事になります。したがって、水素の酸化数は+1、酸素の酸化数は-2となります。
もう1つやってみましょう。次は少し複雑なCH3COOHを考えてみます。
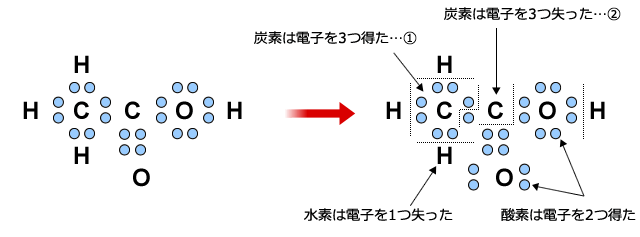
上図のように、CH3COOHでは、2つのC原子の酸化数が異なります。
①のCは結合している3つのHから電子を1つづつ受け取りますが、同じ原子同士の結合では電子のやり取りは生じません。したがって①のCの酸化数は-3となります。
②のCは結合している2つのOに電子を3つ奪われていますので、酸化数は+3となります。
一方、OやHは全て-2、と+1になっています。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

