化学連載 第40回:実在気体のP-V・P-Tグラフ
理想気体の状態方程式のところで P-V グラフ、 P-T グラフ、 V-T グラフなどを扱いましたが、今回は実在気体のこれらのグラフを説明していこうと思います。
しかし、複雑になりすぎるのを避けるため、気体は理想気体の状態方程式に従うものとして、凝縮して液体になる事がある。という意味で実在気体であるという事にします。
さて、気体を容器に入れて圧力を加えていくと、徐々に体積が小さくなっていきます。 A→B のところですね。
しかし、圧力が飽和蒸気圧、 P0(Pa) に達すると、それ以上圧力は大きくならず、液体が生じ始めます。
このあたりは飽和蒸気圧の所で説明した通りですね。 B→C のところです。
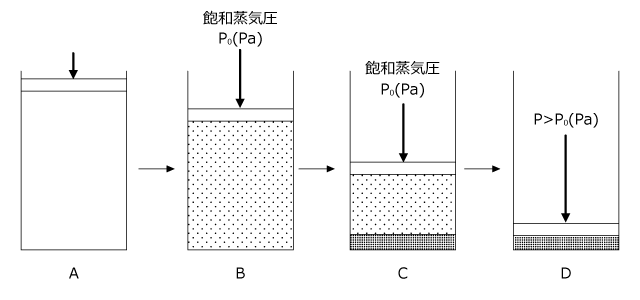
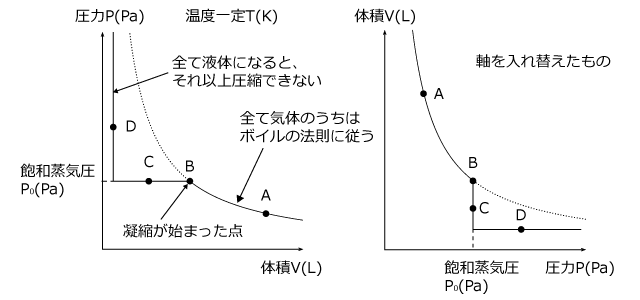
さて、これを P-V グラフにすると下図のようになります。左の図は右から左に見ていかないといけませんからちょっと見にくいですけれど、圧縮していくと、圧力がだんだん上がっていって、飽和蒸気圧になった瞬間に圧力が一定になって、体積だけが小さくなっていくのが分かりますね。
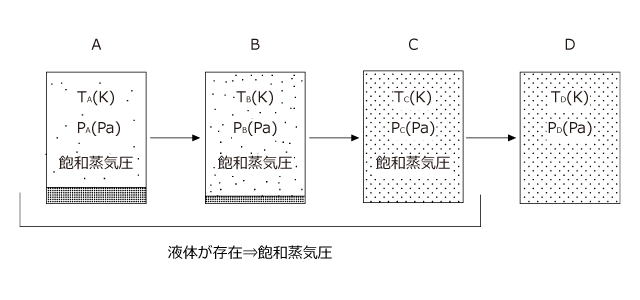
次は、体積一定の容器に入れた液体を加熱して温度を上昇させたときの温度と圧力の関係について説明します。
体積一定の真空容器に液体を入れ、しばらく放置すると圧力がその温度での飽和蒸気圧となって気液平衡に達します。 A の状態です。
この温度を徐々に上げていくと、蒸気圧曲線にそって圧力が増加していきます A→B
しばらくすると全ての液体が気体となり、それ以降はシャルルの法則に従って温度と圧力が比例関係になります。
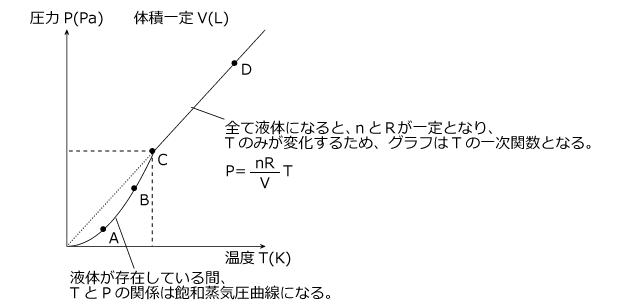
ここまでをグラフにすると、下図のような形になり、全てが気体になるまでは飽和蒸気圧曲線。
それ以降は直線となります。
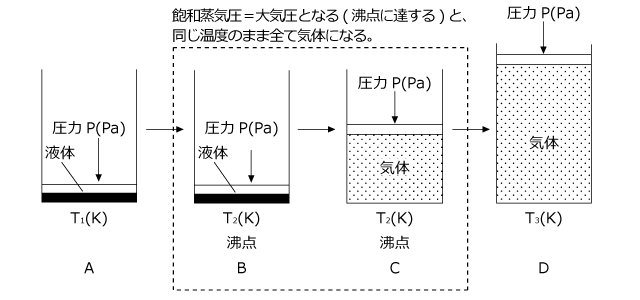
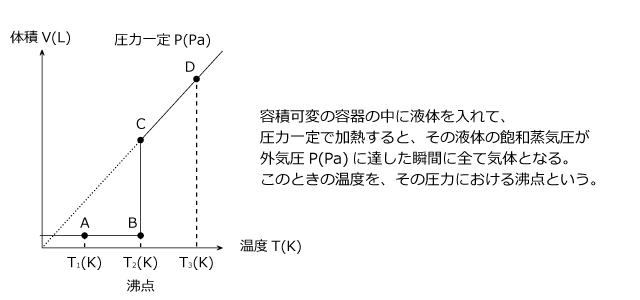
圧力一定で温度を上昇させたときの体積変化について説明します。容器に液体を入れ、その上から自由に動くことができる「ふた」をして液体とふたの間の空気を抜くと、 A のように気体部分がなくなって、液体の上にふたが浮いている状態になります。
これは、この温度での液体の飽和蒸気圧が大気圧 P(Pa) を下回っているためです。この温度を徐々に上げていくと、飽和蒸気圧が徐々に大きくなっていきます。飽和蒸気圧が大気圧 P(Pa) と同じになると、液体が気体になり始めてピストンが持ち上がり、温度一定のまま全て気体になります。 B→C
全て気体になると、 V と T は比例の関係になり、グラフは直線となります。 C→D
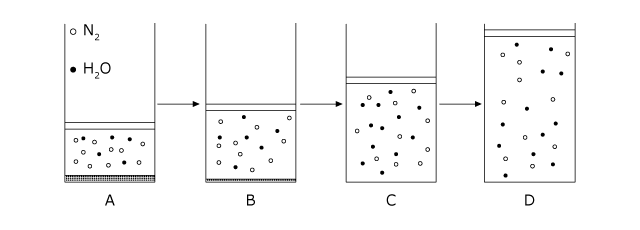
最後に、二種類の気体が含まれている場合の P-V グラフを考えてみましょう。ただ、両方とも気体では面白くありませんから、片方は窒素のように普通の圧力や温度の範囲では凝縮しない気体。もう片方は水のように凝縮する可能性のある気体という事にします。
さて、温度を一定に保って n1mol の N2 と n2mol の H2O を体積可変の容器に入れると、 H2O は一部が凝縮して液体となり、圧力は飽和水蒸気圧になります。 N2 は全て気体のままです。
ここから圧力を下げていくと (A→C) 体積が徐々に大きくなっていきます。それと同時に H2O は蒸発して気体となっていきます。なぜなら、水が存在している以上、水蒸気の分圧は飽和水蒸気圧でなくてはいけないからです。
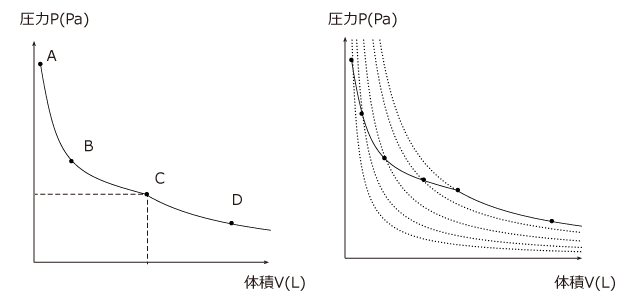
さて、ここまでの変化は、 P-V グラフ上でどのようになるでしょうか。まず、気体の状態方程式を使って考えてみます。 水が蒸発するとそれだけ気体分子の物質量が増加します。すると ![]() の右辺の分子、つまり反比例の式の比例定数が増加しますから、下図の A~C のように、反比例のグラフの外側のグラフにどんどん移っていきます。逆に、水が全て蒸発した後は、これ以上気体の物質量は増加しないので、 PV= (一定)になります C→D
の右辺の分子、つまり反比例の式の比例定数が増加しますから、下図の A~C のように、反比例のグラフの外側のグラフにどんどん移っていきます。逆に、水が全て蒸発した後は、これ以上気体の物質量は増加しないので、 PV= (一定)になります C→D

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

