理論化学
無機化学
第1回 金属のイオン化傾向
無機化学で取り扱う物質は、大きく金属と非金属の二種類に分類されます。
この広義では、金属から説明していきます。
普通は、各物質についてバラバラに覚えていきますが、それは少し効率が悪いので、まず、大雑把に性質をまとめて、それから各物質について詳しく説明していくことにします。
第1回は、金属のイオン化傾向と、金属の反応についてのまとめ、第二回は、金属の陽イオンの沈殿と錯イオン、合金などについて、第三回では陽イオンの系統分析ををまとめますが、これらの内容を理解して覚えれば、かなり見通しが良くなるはずです。
では、第1回を始めます。
金属は電気陰性度が小さいため陽イオンになりやすく、金属の反応のは、電子を失って陽イオンになる反応です。
ここで、金属が陽イオンになるなりやすさ、即ち、反応のしやすさを示すのがイオン化傾向です。
つまり、
- イオン化傾向の大きな金属=反応しやすい(電子を奪われやすい=酸化されやすい)金属
- イオン化傾向の小さな金属=反応しにくい(電子を奪われにくい=酸化されにくい)金属
ということです。つまり、イオン化傾向とは、金属の酸化されやすさの指標なのです。
この考えに基づいて次の表を考察すると、わかりやすく、覚えやすいと思います。ざっと見てみると、空気、水、酸のどれとの反応でも、イオン化傾向の大きな金属のほうが激しく反応するのがわかりますね。
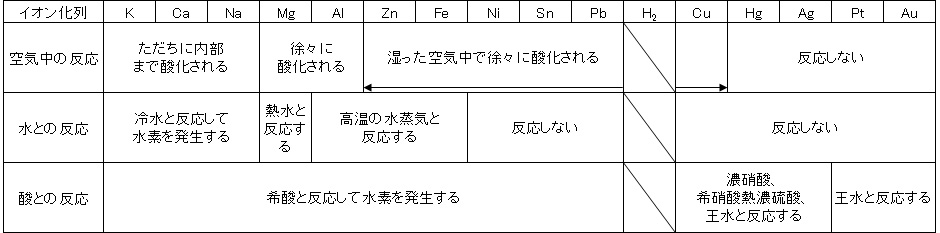
これらの反応について1つずつ説明していきます。
空気と金属の反応
これは、空気中の酸素と金属の反応です。酸素は電気陰性度が大きな元素なので、電気陰性度の小さな金属元素から電子を奪い、酸化します。したがって、イオン化傾向の大きな金属ほど、激しく反応します。

イオン化傾向の大きな、K、Ca、Na は、空気に触れるとただちに内部まで酸化されて、酸化物になってしまいます。そのため、これらの金属は石油(流動パラフィン)中または不活性ガス中に保存します。
(K よりもイオン化傾向の大きな Li も石油中に保存しますが、よりイオン化傾向が大きく、反応性が高いRbやCsは、不活性ガスを充てんしたガラス管の中で保存します。)
大学入試では、「Li、K、Na の三種類を石油中に保存する」が問われます。
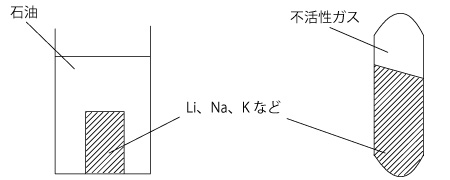 Li、Na、Kは、空気、水蒸気、二酸化炭素などと反応する。
Li、Na、Kは、空気、水蒸気、二酸化炭素などと反応する。
そのため、石油中に保存する。
【不活性ガスを充填した封管に保存する場合もある。】
K、Ca、Naよりイオン化傾向の小さなMg、Alは内部まで酸化されず、表面が徐々に酸化されます。
1円玉はアルミニウムでできていますが、金属光沢が少なく、くすんだ色をしています。これは、表面が酸化アルミニウムになっているためです。
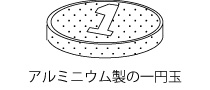 表面が酸化され、Al2O3となるため、金属光沢のないくすんだ色になっている。
表面が酸化され、Al2O3となるため、金属光沢のないくすんだ色になっている。
Alの酸化物は、ち密で丈夫なため、表面を人工的に酸化して製品に用います。これをアルマイトと言います。
 アルミニウムの表面をあらかじめ酸化しておくことで、腐食に強くする。(アルマイト)
アルミニウムの表面をあらかじめ酸化しておくことで、腐食に強くする。(アルマイト)
ZnからCuまでの元素は湿った空気中で徐々に酸化されます。このようにして生じる鉄の酸化物は、赤褐色のFe2O3です。また、Cuは複雑な化学式の、緑色の錆、緑青となります。神社や一部の城の屋根は銅で作られていて、表面が緑青になっているため緑色になっています。
水と金属の反応

水と金属の反応では、次のように、水酸化物と水素が発生します。
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
2Na + 2H2 O → 2NaOH + H2
2Al + 6H2 O → 2Al (OH)3 + 3H2
ここで、イオン化傾向の大きな金属ほど、温度の低い水と反応していますが、これはどうしてでしょうか。
実はこの反応は、水が電離して生じるH+と、金属の間で起こる酸化還元反応が本質なのです。
H2O ⇔ H+ + OH- ... ①
例えば、ナトリウムとの反応であれば次のような反応です。
2Na + 2H+ → 2Na+ + H2 ... ②
②の反応式の両辺に 2OH- を加えると、次のようになります。
2Na + 2H+ + 2OH- → 2Na+ + H2 + 2OH-
H2O はほとんど電離しませんので、①を用いて H+ + OH-をまとめて H2O とします。
すると、2Na + 2H2O → 2NaOH + H2 が得られます。
このように、水と金属の反応は、酸と金属の反応と同じなのです。
では、なぜ、イオン化傾向の大きさと反応する水の温度が関係するのかというと、水は、温度が高いほど電離度が大きくなるためと、温度が高いほど、原子や分子やイオンの熱運動が激しく、反応しやすくなるためです。
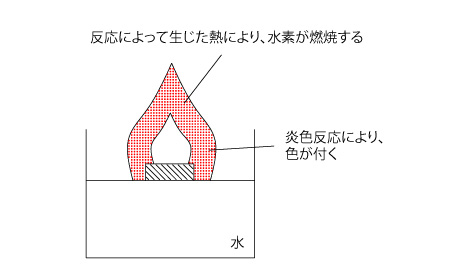
そのため、アルカリ金属やアルカリ土類金属は冷水と反応して水素を生じますが、アルミニウムや亜鉛や鉄は高温の水蒸気としか反応しないのです。
ちなみに、アルカリ金属やアルカリ土類金属を水に入れると発火します(そのため、消防法で禁水性物質として指定されています)が、これは、反応によって生じた水素が、反応熱によって発火するためです。
酸と金属の反応

金属と酸が反応する反応は、塩酸や希硫酸のような希酸との反応と、濃硝酸、希硝酸、熱濃硫酸、王水のような酸化力のある酸との反応にわけることができます。
希酸は水中で電離して H+ を生じます。この H+ が金属を酸化して、金属を陽イオンとし、自らは水素になります。
例えば、鉄やナトリウムなら、次のような反応をします。
2Na + 2H+ → 2Na+ + H2
Fe + 2H+ → Fe2+ + H2
この反応は、H2 より酸化されやすい金属、つまり、上の表の H2 よりイオン化傾向の大きな金属で起こります。
逆に、H2 よりイオン化傾向の小さな金属では、この反応は起こりません。これらの金属は、H+よりも、もっと酸化力の強い物質としか反応しないのです。
濃硝酸、希硝酸、熱濃硫酸、王水などは、非常に酸化力が強く、CuやHgやAgといった、H+では酸化できない金属を酸化することができます。
濃硝酸、希硝酸、熱濃硫酸と Cu や Ag との反応は、模試でも入試でも頻出ですので、覚えておきましょう。これらの反応式の書き方は、第二十一回を参考にしてください。
ここには、結果と注意点を書いておきます。
-
①熱濃硫酸との反応(二酸化硫黄【無色、刺激臭】が生じることに注意)
Ag + 2H2S4O → Ag2SO4 + SO2 + 2H2O
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
-
②希硝酸との反応(一酸化窒素【無色、無臭】が生じることに注意)
3Cu + 8HNO3 → 3Cu03(NO3)2 + 4H2O + 2NO
3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO
-
③濃硝酸との反応(二酸化窒素【赤褐色、刺激臭】が生じることに注意)
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
Ag + 2HNO3 → AgNO3 + H2O + NO2
王水は、ほかの酸とは全く反応しない白金や金とも反応する酸で、濃硝酸と濃塩酸を1:3の割合で混合したものです。(一生三円と覚えましょう。)
酸と金属の反応の例外
次のことは、よく問われますから注意が必要です。
-
①Al、Fe、Ni(Cr、Co)は濃硝酸、熱濃硫酸に溶けない(希硝酸には溶ける)
【ゴロ:黒(Cr)子(Co)に(Ni)会(Al)って(Fe)不動態】
これらの金属は、濃硝酸や熱濃硫酸と反応すると、表面にち密な酸化被膜を生じます。この酸化被膜は非常に安定で、反応しにくいので、これらの金属は濃硝酸、熱濃硫酸に溶けません。
このように表面が酸化被膜に覆われて耐薬品性、耐腐食性が大きくなった状態を、不動態と言います。(アルマイトも不動態です。)
希硝酸は、酸化力もありますが強酸で電離度が大きく、 H+を多く放出するため、これらの金属を溶かします。
-
②Pb は塩酸、硫酸に溶けない。
Pb2+ は Cl-、SO42- と結びついて、水に不溶の塩である PbCl2 や PbSO4 を生じます。
その不溶の塩が表面を覆ってしまうため、Pbは塩酸、硫酸に溶けません。
【ゴロは、第二回で紹介します】





















































