理論化学
無機化学
第4回 金属の陽イオンの系統分析
今回は、定期テストでも、模試でも、大学入試でも頻出の、陽イオンの系統分析の問題の解き方を解説します。
まず、第1回~第3回の内容が暗記できているか確認してください。
暗記できていたら、さらに、次の表を覚えましょう。
水酸化物の沈殿に、アンモニア水や水酸化ナトリウム水溶液を過剰に加えると、錯イオンが生じて沈殿が溶解することがあります。どの組み合わせで沈殿が溶解するのかを覚えておきましょう。
この表と、第2回、第3回の内容で、陽イオンの系統分析の問題は全て解けるようになります。
| 水酸化物 | 過剰の NaOH 水溶液 3 | 過剰の NaOH 水溶液 |
|---|---|---|
| Al(OH)3 | × | [Al(OH)4]- |
| Zn(OH)2 | [Zn(NH3)4]2+ | [Zn(OH)4]2- |
| Sn(OH)2 | × | [Sn(OH)4]2- |
| Pb(OH)2 | × | [Pb(OH)4]2- |
| Cr(OH)3 | × | [Cr(OH)4]- (灰緑) |
| Ag2O | [Ag(NH3)4]+ | × |
| Cu(OH)2 | [Cu(NH3)4]2+ (濃青) | × |
| Ni(OH)2 | [Ni(NH3)6]2+ (青紫) | × |
※色の書いてないものは、無色
※ほとんど出ません → 陽イオンの系統分析では出ません。
覚え方は、次の通り。(といっても、第3回に出てきたものばかりですね。)
- 過剰の NaOH 水溶液によって溶解 : 両性元素 (あ あ すん な りと くろう しろ)
- 過剰の NH3 水溶液によって溶解 : (あえ いだ あげ く どう せ に げていく)
Cr3+ は NH3 と錯イオンを生成しますが、Cr3+ は NH3 水溶液を過剰に加えてもほとんど溶けません。これは、沈殿の安定性と錯イオンの安定性の兼ね合いによるもので、大学受験で出題される、沈殿が錯イオンとなって溶解する知識は、とりあえずこの表と、ハロゲン化銀の溶解(銀について解説する章で述べます)について覚えておけば十分です。
次に、練習問題をやりながら、系統分析の操作を説明します。これは覚えようとしなくてもいいです。自然と覚えるまでやってください(笑)。
練習問題①(ウォーミングアップ)
次の(1)~(5)について、各イオンを沈殿させて分離するために操作を行った。各沈殿①~③の化学式を書きなさい。
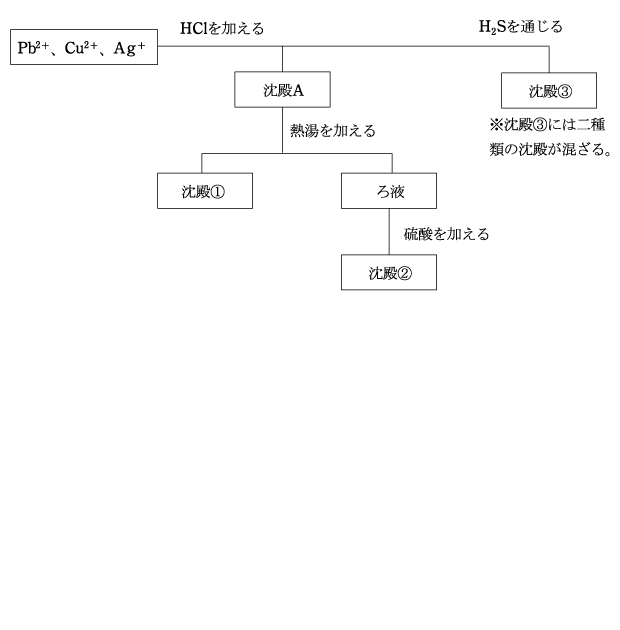
(1) Pb2+、Cu2+、Ag+ の分離
【解答】
- ① Cl- で沈殿するのは、Pb2+、Hg22+(Hg+)、Ag+
- ② PbCl2 は熱水に溶ける。
- ③ SO42- で沈殿するのは、Ba2+、Ca2+、Pb2+、Sr2+(アルカリ土類と鉛)
- ④ PbCl2 は溶解度が大きいので、ろ液に H2S を通じると PbS が沈殿する。
HCl の電離によって生じた Cl- により、Pb2+ と Ag+ がそれぞれ PbCl2 と AgCl として沈殿する。(沈殿A)
PbCl2 は熱水に溶けるため、沈殿Aに熱水を加えると、 AgCl が沈殿として残り(沈殿①)、ろ液には Pb2+ が含まれる。このろ液に H2SO4 を加えると、PbSO4 が沈殿する。(沈殿②)
沈殿Aをこしとったろ液に H2S を通じると、CuS と PbS が沈殿する。
Pb2+ は沈殿Aで PbCl2 として沈殿しているが、PbCl2 は溶解度が比較的大きいため、沈殿③には PbS が混入する。
※この PbS の沈殿は、少し戸惑うと思うが、こういう物質はこれだけなので覚えてください。
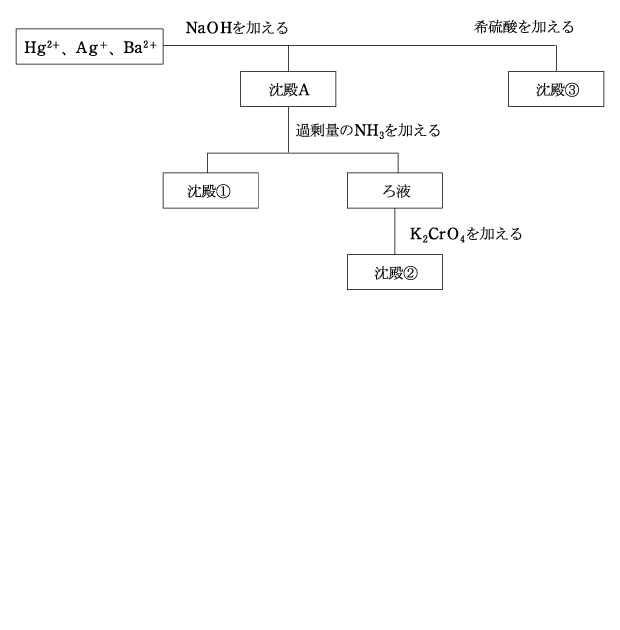
(2) Hg2+、Ag+、Ba2+ の分離
【解答】
- ① 塩基性で沈殿しないのは、アルカリ金属とアルカリ土類金属。(錯イオンを形成する場合を除く。)
- ② SO42- で沈殿するのは、アルカリ土類金属と鉛。
- ③ NH3 を多量に加えると、Zn(OH)2、Ag2O、Cu(OH)2、Ni(OH)2 はアンミン錯イオンとなって溶解する。
- ④ CrO42- と沈殿を作るのは、Ag+、Pb2+、Ba2+
NaOH を加えて水溶液を塩基性にすると、アルカリ金属とアルカリ土類金属以外の金属陽イオンが沈殿する。Hg2+ と Ag+ は、ともに水酸化物ではなく、酸化物の HgO と Ag2O が沈殿します。
Ag2O は過剰量の NH3 によってアンミン錯イオンとなり溶解しますが、HgO は溶解せず、沈殿のままです。(沈殿①)
[Ag(NH3)2]+ に CrO42- を加えると、Ag2CrO4 が沈殿します。(沈殿②)
Ba2+ は SO42- と結びついて BaSO4 となり、沈殿します。(沈殿③)
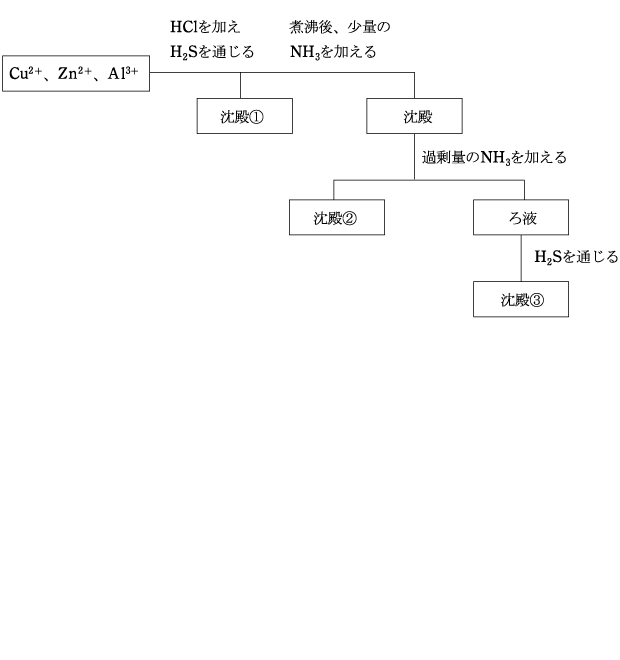
(3) Cu2+、Zn2+、Al3+ の分離
【解答】
- ① 酸性でも Pb2+、Cd2+、Cu2+、Hg2+、Sn2+、Ag+ は H2S により沈殿する。
- ② Zn2+ は OH- とも NH3 とも錯イオンを形成する。
- ③ Al3+ は OH- と錯イオンを形成するが、NH3 とは形成しない。
- ④ 中性、塩基性では Fe2+、Co2+、Ni2+、Mn2+ は H2S により沈殿する。
HCl を加えて酸性にして、H2Sを通じると、CuS のみが沈殿する。(沈殿①)
HCl を加えないと、ZnS も沈殿してしまいます。
煮沸して H2S を揮発させて塩基性にする。H2S を揮発させないと、塩基性にした際に ZnS が沈殿してしまいますが、ZnS は過剰量の NH3 によっても錯イオンを形成しません。(詳しくは練習問題の後ろに記載【補足:硫化物の溶解】を参照してください。)
塩基性となったので、Al(OH)3 と Zn(OH)2 が沈殿します。
過剰量の NH3 を加えると、Zn(OH)3 は [Zn(NH3)4]2+ となって溶解しますが、Al(OH)3 は錯イオンを形成せず、溶解しません。(沈殿②)
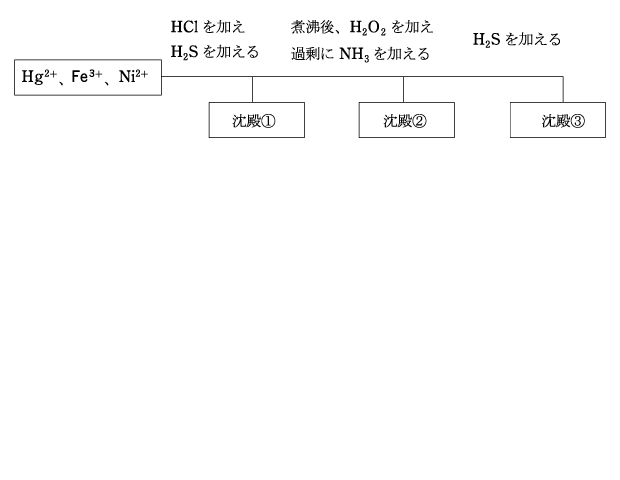
(4) Hg2+、Fe3+、Ni2+ の分離
【解答】
- ① 酸性でも Pb2+、Cd2+、Cu2+、Hg2+、Sn2+、Ag+ は H2S により沈殿する。
- ② Fe2+ は OH- によって沈殿するが、Fe(OH)2 は溶解度が比較的大きい。
- ③ Fe2+ を酸化して Fe3+ にするため、 H2O2 または HNO3 を加える。
- ④ NH3 を多量に加えると、Zn(OH)2、 Ag2O、Cu(OH)2、Ni(OH)2 はアンミン錯イオンとなって溶解する。
- ⑤ 硫化物は錯イオンを形成しないので、煮沸により H2S を追い出す。
HCl を加えて酸性にして H2S を通じると、Hg2+ が HgS として沈殿する。(沈殿①)
この時、H2S によって Fe3+ が還元されて Fe2+ になります。
煮沸して H2S を揮発させます。こうしないと、NH3 によって塩基性にしたとき、Fe(OH)3 と一緒に NiS が沈殿してしまいます。
酸化剤として働く H2O2 を加え、Fe2+ を酸化して Fe3+ とします。Fe(OH)2 は比較的溶解度が大きく、完全に沈殿しない上に硫化物を作り、沈殿③に混入してしまうため、溶解度が小さく、硫化物を作らない Fe3+ にするのです。
過剰の NH3 を加えると、Fe(OH)3(沈殿②)と [Ni(NH3)6]2+ が生じます。塩基性となったろ液に H2S を加えると NiS が沈殿します。(沈殿③)
(5) Ag+、Ca2+、Sr2+ の分離
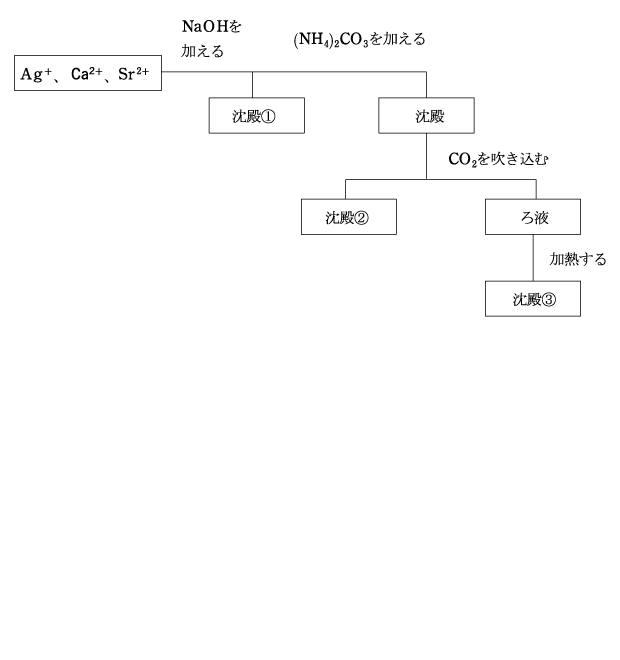
【解答】
- ① 塩基性にすると、アルカリ金属、アルカリ土類金属以外は沈殿する。(錯イオンを形成する場合を除く。)
- ② Ag+ は水酸化物ではなく、酸化物が沈殿する。
- ③ アルカリ土類金属は CO32- により沈殿する。
- ④ CaCO3 は過剰量の CO32- に溶解するが、加熱すると CaCO3 として再沈殿する。
アルカリ土類金属の Ca2+ と Sr2+ は塩基性にしても沈殿しませんが、Ag+ は Ag2O となって沈殿します。(沈殿①)
(NH4)2CO3 は水中で電離して CO32- を放出し、Ca2+ と Sr2+ はそれぞれ CaCO3 と SrCO3 として沈殿します。
ここに CO2 を吹き込むと、CaCO3 は Ca(HCO3)2 となって溶解しますが、SrCO3 は沈殿したままです。(沈殿②)
ろ過して SrCO3 をこしとったろ液を加熱すると、Ca(HCO3)2 が分解して CaCO3 として再沈殿します。(沈殿③)
練習問題②
次の沈殿 A ~ E およびろ液 F に含まれる沈殿およびイオンを化学式で示せ
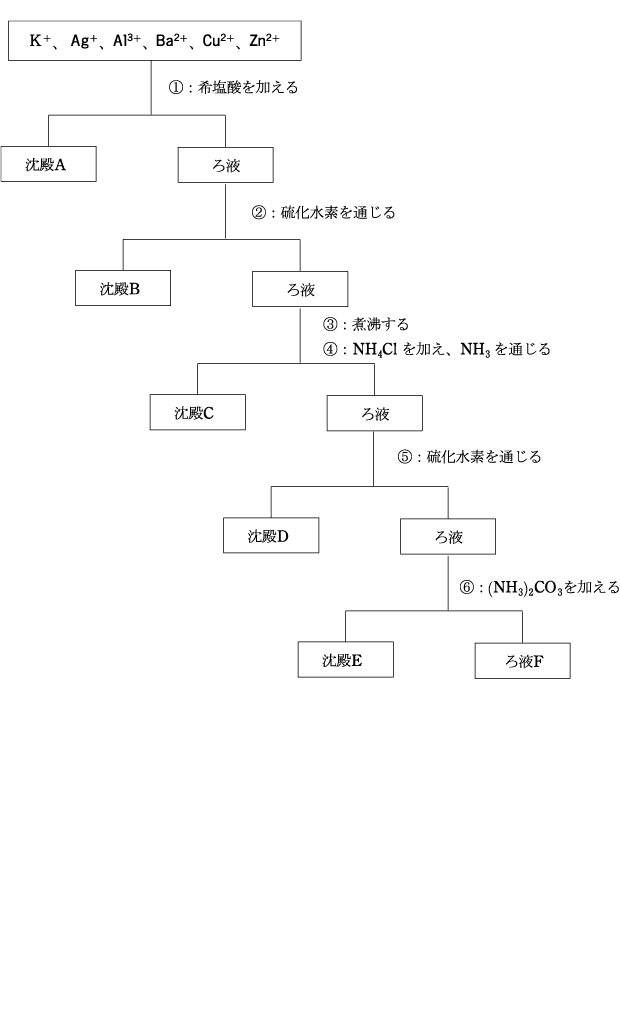
【解答・解説】
※ 大前提
アルカリ金属は沈殿しません。何をしても沈殿しません。
ですので、アルカリ金属のイオンがあったら、真っ先に一番最後のろ液(上澄み)に分類してください。
ろ液F:K+
① HCl を加える
HCl を加えると、Pb2+、Hg22+Ag+ が沈殿します。(Hg22+ の出題はまれ)
沈殿A: Ag2S
② H2S を加える
HCl を加えた後の水溶液は、強い酸性になっています。
そこに H2Sを加えます。
酸性水溶液 + H2S ですから、Pb2+、Cd2+、Cu2+、Hg2+、Sn2+ が沈殿します。
沈殿B:CuS
③ 煮沸する
煮沸するのは H2S を追い出すためです。この後 NH3 を加えて塩基性にしますが、その時に塩基性 + H2S で沈殿するイオンが沈殿しないようにするためです。
硫化物は過剰量の NaOH や NH3 によって錯イオンを作らないので、この操作が必要です。
④ NH3 過剰量と NH4Cl を加える。
塩基性となったので、残っていた金属イオンのうち、アルカリ金属を除くすべての金属が沈殿します。しかし、Zn2+、Ni2+ はアンミン錯イオンとなるため、沈殿しません。
NH4Cl を加えるのは、緩衝溶液にして pH が大きく変化しないようにするためです。
沈殿C:Al(OH)3
⑤ H2Sを吹き込む。
塩基性で H2S を加えると、②で沈殿しなかった陽イオン、Co2+、Ni2+、Zn2+、Mn2+ が沈殿します。
沈殿D:ZnS
⑥ CO2を吹き込む、または、(NH4)2CO3 を加える。
CO2 は多くの金属イオンを沈殿させますが、この時点で残っているのは、沈殿を作らないアルカリ金属と アルカリ土類金属 です。アルカリ金属は沈殿しないので、沈殿するのはアルカリ土類金属です。
沈殿E: BaCO3





















































