理論化学
化学講座 第7回:分子の極性と分子間に働く力、分子性物質
分子の極性
さて、異なる種類の原子間に働く共有結合では、電気陰性度の違いに基づく電荷の偏りが生じます。つまり、電気陰性度の大きな原子のほうに共有電子対が引き寄せられ、その原子が負に帯電する一方で、もう一方の原子は正に帯電します。これは前回お話ししましたね。

今回は、分子全体の電荷の偏りを考えてみます。まず、メタンと二酸化炭素を例にとって考えてみましょう。
下図を見ると分かるように、メタンや二酸化炭素では、炭素と水素、炭素と酸素は電気陰性度の大きさが違いますから、1つ1つの結合には電荷の偏りがあります。しかし、分子の形が対称形ですから、分子全体ではその偏りが打ち消しあってしまうのです。ですから、分子全体での電荷の偏り、つまり、分子の極性は無いのです。
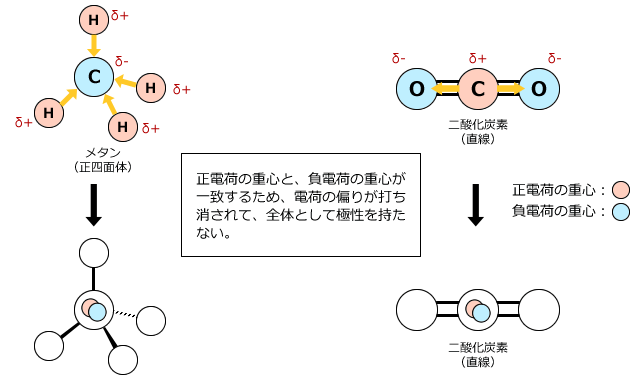
ただ、分子の形状が対称形だと電荷の偏りが打ち消されるという説明だけでは今ひとつわかりにくいですよね。そこで、分子全体の電荷の偏りは、電荷の重心の位置を考えると良く分かります。無極性分子では、正電荷の重心と負電荷の重心が一致するため、電荷の偏りがなくなり、極性分子では正電荷の重心と負電荷の重心が一致しないため分子全体に電荷の偏りが生じるのです。
例えば、メタンと二酸化炭素では正電荷の重心と負電荷の重心が一致します。そのため、正電荷と負電荷がお互いに打ち消し合ってしまい、全体は無極性になるのです。
次に、クロロメタンを考えて見ましょう。分子の形状が非対称形をしていますね。ですから、分子内にある結合に生じている電荷の偏りは打ち消されず、分子全体でも電荷の偏りを生じます。つまり、クロロメタンには極性があるのです。
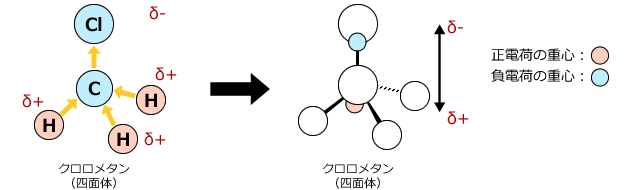
これも電荷の重心の位置で考えてみましょう。上図右側が電荷の重心位置を示したものですが、負電荷がやや上の方(Cl原子に近い方)にあるのに対し、正電荷の重心位置はやや下の方(H原子に近い方)にあって、電荷の重心位置は一致しません。これは、この分子を作っている元素の中で、塩素原子が最も電気陰性度が大きく水素原子が最も電気陰性度が小さいためです。
電気陰性度の大きい塩素が電子を強く引き付けてしまっているんですね。
したがって、クロロメタンではClの方がやや負に帯電し、Hの方がやや正に帯電しているのです
分子間力
原子の性質はその原子の最外殻電子数によって決まりますが、物質の性質はその物質を構成する分子、あるいは原子、イオン間に生じる結合の強さによって決まります。例えば、融点や沸点は物質の熱運動が結合による束縛に打ち勝つ瞬間の温度なので、結合が強くなるほど高くなります。
分子とは、共有結合でいくつかの非金属元素の原子が結合してできた「原子のかたまり」であるという事は前回説明しましたが、今回は、分子間に働く力と、分子で構成された物質の性質について説明します。
分子間には大きく分けて2種類の引力が働いています。1つはファンデルワールス力といって全ての分子間に働く、共有結合の100分の1位の大きさの非常に弱い力です。もう1つは水素結合といって水素とフッ素、水素と酸素、水素と窒素の結合を持つ分子間にはたらく力で、共有結合の10分の1くらいの大きさの、ファンデルワークス力よりはずっと強い力です。
分子間には2種類の引力が働く。
・ファンデルワールス力 (全ての分子間)
・水素結合 (一定の条件を満たした分子間)
これらをまとめて分子間力という。
ファンデルワールス力
ファンデルワールス力は分子間に働くクーロン力で、電荷の偏りを持たない無極性分子間にも働きます。
電荷がないのにクーロン力がどうやって働くの?と、疑問に思うかもしれませんね。分子の周りには電子が何重にも取り巻いています。この電子はじっとしているのではなくて、決められた電子軌道の中をランダムに動き回っているのです。
動き回っていると、偶然一方に電子が偏ってしまうことがあります。
つまり、瞬間的には分極した極性分子のようになるのです。
そうすると分極した分子からクローン力を受けて隣の分子の電子も偏ります。
そうすると、この2分子の間にはクーロン力が生じて引きつけ合います。しかし、すぐに電子が移動して分極はなくなってしまうので、この力は瞬間的なものにすぎません。分子で構成される物質の中ではこういう瞬間的な引力がたえず生じては消え、消えては生じているのです。
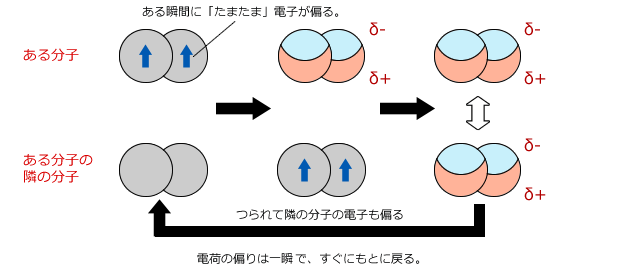
分子間にはたえず瞬間的なクーロン力による引力が働いている。
その時間平均が分子間に働くファンデルワールス力です。
分子間に働く引力を発見したのは、気体の状態方程式を研究していたファンデルワールスでした。彼は、気体分子の挙動を研究している時に、分子間に引力が働いていることに気がついたのです。
ですから、今でも分子間に働く力を全部まとめてファンデルワールス力と呼ぶことがあります。
ただし、この講義ではファンデルワールス力は分子間の瞬間的な分極(瞬間双極子と言います)により生じる力と、極性分子間に働くクーロン力の事を指すことにします。
さて、このファンデルワールス力ですが、正体はクーロン力なので、「電荷が大きく」「距離が近い」ほど強く働きます。このことから分子が大きく(分子量が大きく)形状が直線に近いものほど、ファンデルワークス力は強くはたらきます。
次にこのことについて説明します。
まず分子が大きいと、電荷の偏りも大きくなります。つまり、瞬間的に生じる電荷が大きくなるのです。分子の大きさは分子量で考えればいいですから、分子量が大きければ大きいほどファンデルワールス力は強くなります。
例として水素と臭素の沸点を比べてみましょう。水素の沸点が-252.8℃であるのに対し、臭素の沸点は58.8℃です。これは、分子量が水素(分子量2)より大きな臭素(分子量160)の方が分子間に大きなファンデルワールス力が生じるためです。
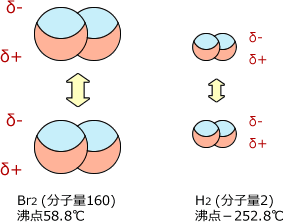
【分子量が大きい=分子が大きい】ほど、電荷の偏りはダイナミックになり、大きく分極するため分子間に働くクーロン力は大きくなる。
分子量が大きいほど大きなファンデルワールス力が働く。
従って、分子量が大きければ大きいほど沸点・融点が高くなる。
次に、分子の形状が細長いと、分子同士はより接近することができます。したがって、分子量が同程度であれば、ファンデルワールス力は細長い形の分子ほど強く働きます。
例としてペンタン(直鎖状)2-メチルブタン(枝分かれ構造)、1,2‐ジメチルプロパンを比較してみると、分子量は全て同じですが、沸点はペンタン>2-メチルブタン>1,2-ジメチルプロパンの順になっています。
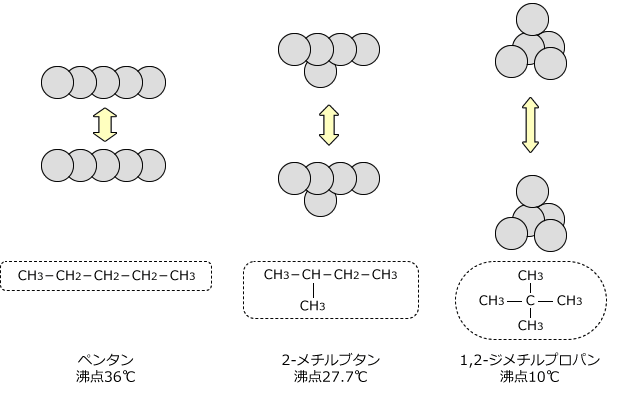
ちなみに、2-メチルブタンはイソペンタン、1,2-ジメチルプロパンはネオペンタンとも言います。この名前で出てくることもありますから、覚えておきましょう。
【分子の形状が直線状に近い】ほど、分子間の距離が近くなるため、分子間に働くクーロン力は大きくなる。
分子の形状直線に近いほど大きなファンデルワールス力が働く。
従って、分子の形状が直線に近いほど沸点・融点が高くなる。
さて、ファンデルワールス力というのは、瞬間的な分極によって生じるクーロン力の時間平均です。それなら、瞬間的でなく、最初から極性を持っている分子間にはより強い力が働くことになりますよね。つまり、極性のある分子は極性のない分子よりも沸点が高くなります。
例えば、無極性分子のフッ素(分子量38)は沸点が-188℃であるのに対し、極性分子の塩化水素(分子量36.5)は沸点が-85.1℃です。
このように、極性分子間には無極性分子間に働く力よりも強い力が働いています。
水素結合
水素結合ができる条件はH-F、H-O、H-Nの結合があることです。例えばHFやH2OやNH3などですね。
F、O、N、の3つは電気陰性度のトップ3です。それに対して、水素は非金属の中でもかなり電気陰性度が弱い元素です。したがって、これらの分子では、水素とF、O、Nの結合にとても大きな極性が存在します。
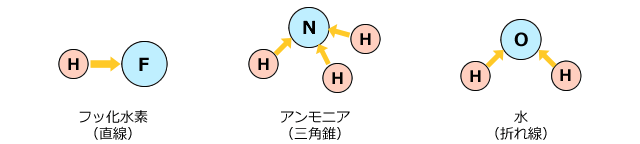
例えば、フッ化水素分子では、電子軌道にあった電子はフッ素原子に強く引き付けられてしまい、水素原子の周りには電子がほとんどない状態になってしまいます。
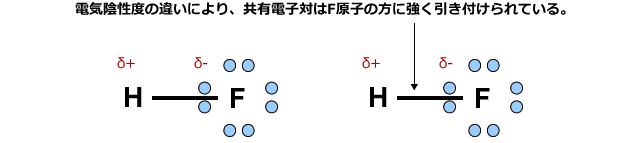
すると、この水素は近くにあるF原子の非共有電子対を一部取り込んで安定化します。つまりH原子が隣のF原子に配位結合的に結合するわけです。これが水素結合の正体です。
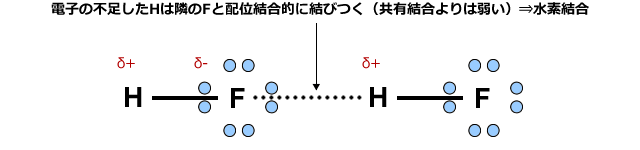
ただし、水素結合はあくまで配位結合に似たメカニズムで生じるというだけで、結合の強さはずっと弱く、配位結合(共有結合)の10分の1程度です。でも、無極性分子間に働くファンデルワールス力よりは10倍くらい強い力ですから、水素結合を形成している物質の沸点は、無極性分子が集まってできる沸点よりずっと高くなります。
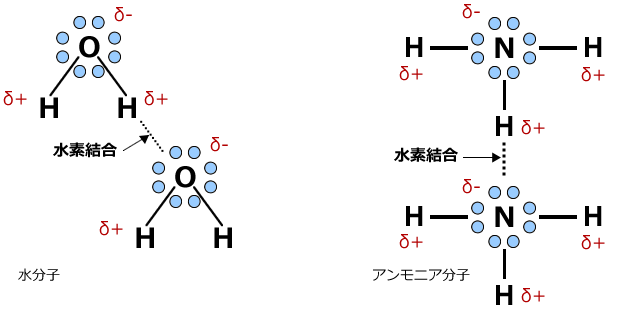
水分子やアンモニア分子間には上図のように水素結合が生じます。この水素結合が生じる方向は決まっています。分子の形状で説明したように、非共有電子対は原子核の周りに均一に広がっているわけではなく、ある特定の方向に広がっています。水素結合はその広がりの方向にしか生じないのです。
水分子はこの水素結合のおかげで様々な性質を示します。例えば、液体より密度の低い固体等です。これは、水素結合が生じる方向が決まっているため、固体はスカスカで密度が小さくなってしまうからです。
実は、我々人類が地球上で生活できるのは、水分子が水素結合によって生じる性質のおかげなのです。このことについては次回、詳しくお話します。
分子性物質
分子からなる物質を分子性物質という。
分子間に働く力よわいため、分子性物質は沸点融点が低く昇華する物質もある。
| 名称 | 分子性物質 |
|---|---|
| 構成粒子 | 分子 |
| 化学式 | 分子式 |
| 結合の種類 | 共有結合、分子間力 |
| 硬さ | 軟らかい |
| 沸点 融点 |
低い 常温で気体、液体のものも多い 常温で昇華するものもある |
| 電気伝導性 | 水中で電離して電気伝導性をしめすものがある |