第18回:酸と塩基(5)
(解答・解説)
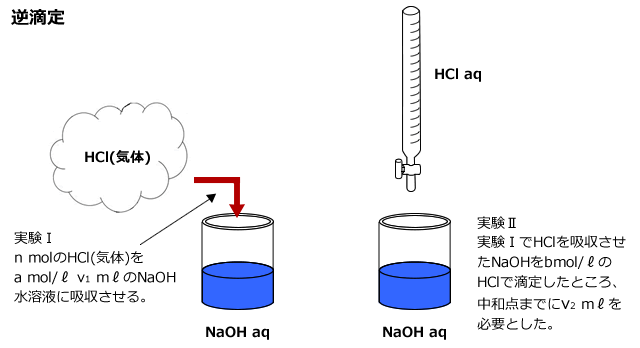
気体に含まれるHClの物質量をn molとおいて、まず、実験Iにおける中和反応を考えてみましょう。
実験Iでは、気体中に含まれるHCl と、水溶液に含まれるNaOHが下式で表される反応をします。
HCl + NaOH → NaCl + H2O ・・・・①
気体に含まれるHClの物質量はn mol 、水溶液に含まれるNaOHの物質量はa×![]() molです。
molです。
①式より、HClとNaOHは1:1の割合で反応しますから、a× ![]() - n molのNaOHが反応せずに残ります。
- n molのNaOHが反応せずに残ります。
次に、残ったNaOHを実験IIで滴定すると、b mol/ℓ のHClがv2mℓ 必要でした。
中和の公式【H+の物質量】=【OH-の物質量】より![]() が成立します。
が成立します。
これを解くと、![]() mol となり、HClの物質量がわかります。
mol となり、HClの物質量がわかります。
(解答・解説)
もう少し楽にやれる方法も紹介しておきます。
この実験は、a mol/ℓのNaOHaq v1mℓをのHClで二回に分けて中和していると考える事もできますよね。
すると、加えたH+の物質量とOH-の物質量は等しくなるはずです。
【H+の物質量】= n×1+b×![]() ×1 mol
×1 mol
【OH-の物質量】= a×![]() ×1 mol
×1 mol
【H+の物質量】=【OH-の物質量】よりn×1+b×![]() ×1=a×
×1=a×![]() ×1
×1
これを解くと、![]() mol
mol
こちらのほうが楽ですよね。
逆滴定では【H+の物質量の総和】=【OH-の物質量の総和】を考えれば良いわけです。
ただし、途中で溶液の一部を取り出す操作がある問題ではこの方法は使えないので注意してくださいね。
次は、私大医学部入試でも頻出の二段滴定についてお話しします。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

