第22回:酸化と還元④
過マンガン酸滴定の例題
例題 )濃度未知の H2O2 水溶液をホールピペットを用いて 10mℓ とり、蒸留水を加えて 100mℓ にした。
次にこの希釈した H2O2 水溶液をホールピペットを用いて 10mℓ コニカルビーカーにとり、 0.10mol/ℓ の KMnO4 水溶液で滴定したところ、 KMnO4 水溶液を10mℓ加えたところで色が変化した。H2O2水溶液の濃度を求めよ。
(解説・解答)まず、実験の手順を確認します。
H2O2 水溶液 10mℓ をとるのに必要な器具はなんでしょう。一定量の水溶液を正確に量り取るのに用いる器具はホールピペットでしたね。
そして、量り取った H2O2 水溶液に水を加えて 100mℓ にするのですから、量り取った H2O2 水溶液を 100mℓ メスフラスコに入れて標線まで水を加えます。
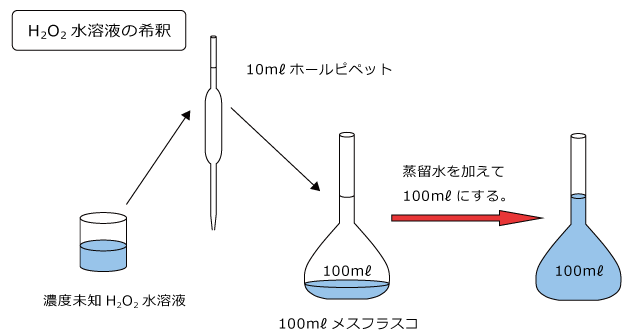
次に、この希釈した H2O2 水溶液をビーカーに移し、ホールピペットで 10mℓ はかりとってコニカルビーカーに入れ、硫酸を加えます。これは、酸化剤が働く為には酸性である必要があるからですね。
ところで、なぜ硫酸なのかというのは前回お話ししましたね。一応復習しておきましょうか。
塩酸や硝酸のような他の強酸でも H+ を供給する事はできますが、塩酸の場合は塩化物イオン (Cl-) が還元剤として働き、硝酸の場合は硝酸イオン (NO3-) が酸化剤として働くため、これらの酸を使用した場合、滴定の結果に誤差を生じるから、用いてはいけないのでしたね。
Cl- ・・・ 還元剤として働く NO3- ・・・ 酸化剤として働く
最後に、ビュレットに KMnO4 水溶液を入れてコニカルビーカーの上にセットしたら滴定開始です。ビュレットからコニカルビーカーに KMnO4 を1滴落とすと、ビーカーの中の溶液が一瞬だけ赤紫色になりますが、すぐに H2O2 と KMnO4- が反応して色が消えてしまいます。
しばらく滴下していると、 H2O2 が無くなって溶液の赤紫色が消えなくなります。 このときが等量点ですね。
H2O2 水溶液の濃度を求めましょう。 H2O2 水溶液の元の濃度を χ mol/ℓ とします。これを10倍に希釈しますから、滴定される H2O2 水溶液の濃度は 10 χ mol/ℓです。
反応に用いた H2O2 水溶液は 10mℓ でしたから、反応した H2O2 は ![]() ×
× ![]() mol です。
mol です。
この H2O2 と過不足なく反応した KMnO4 は濃度が 0.10mol/ℓ で 10mℓ でしたから、物質量は
0.1 × ![]() mol です。
mol です。
次に、半反応式を書きます。
| 過マンガン酸イオン | : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O | ・・・ ① |
|---|---|---|
| 過酸化水素 | : H2O2 → O2 + 2H+ + 2e- | ・・・ ② |
酸化還元反応はe-の数が等しくなるように反応が起こります。①には5e-、②には2e-がありますから、MnO4- : H2O2 = 2 : 5 の割合で反応します。
先ほど求めた物質量の式を代入すると
0.10 × ![]() :
: ![]() ×
× ![]() = 2:5
= 2:5
これを解いて、χ = 2.5mol/ℓ
酸化還元滴定の解き方をまとめておきます。
① 等量点までに滴下した酸化剤・還元剤の物質量をそれぞれ求める。
② 酸化剤・還元剤の半反応式を書き、酸化剤と還元剤がどのような比で反応するか調べる。
③ ①で求めた物質量を用いて②から比の式を作る。
④ ③の式を解くと、求めたい値が求まる。
今回はこれでおしまいです。
お疲れ様でした。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

