第23回:酸化と還元⑤
CODの測定の理論
有機物は非常に酸化しにくく、酸素も常温ではさほど反応性が高くありません。したがって、水中の有機物を、酸素で直接酸化するのはそれほど適当な操作とは言えないですね。
そこで、反応性の高い酸化剤の過マンガン酸カリウムを使って水中の有機物を酸化し、消費された過マンガン酸カリウムの量を酸素に換算してCODを求めます。
河川水のCOD を測定する方法を説明します。
【操作①】硝酸銀を加えて、水中の Cl- を AgCl として沈殿させ、これをろ過により取り除きます。
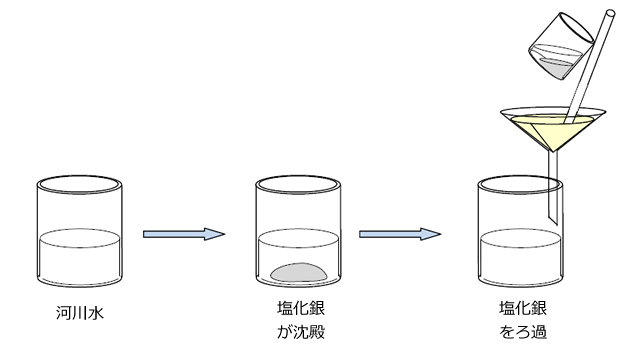
河川などの水を採取した場合、特に、河口近くでは水中にCl-が多く含まれています。Cl-は還元剤として作用するので、Cl-が試料水中に存在すると測定に誤差が生じてしまいます。
ですから、この反応によってあらかじめ取り除いておく必要があるのです。
【操作②】①で処理した試料水に、過剰の過マンガン酸カリウムと硫酸を加え、加熱して有機物を完全に酸化します。溶液は余った過マンガン酸カリウムによって赤紫色になります。
有機物は還元剤として反応するのですが、反応は非常にゆっくりなので、過マンガン酸カリウムによる普通の酸化還元滴定はできません。
ですから、過剰量の過マンガン酸カリウムを加えて加熱し、完全に有機物を酸化した後、余った過マンガン酸カリウムを操作③の滴定で測定し、有機物を酸化するために消費された過マンガン酸カリウムの物質量を求めます。
【操作③】シュウ酸を過剰量加えると溶液の赤紫色が消えて無色になります。ここで、余ったシュウ酸を過マンガン酸カリウムで滴定します。当量点は溶液が赤紫色になった時点です。
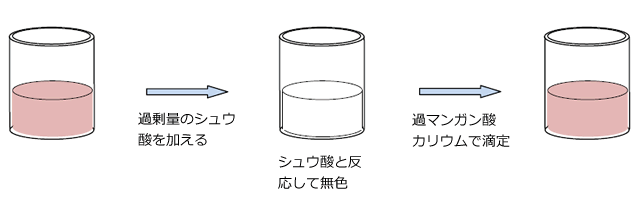
シュウ酸により余った過マンガン酸カリウムを直接滴定せず、逆滴定で測定するのは、人間の目は赤紫色が消えた瞬間をとらえるよりも、溶液が赤紫色になる瞬間をとらえる方が誤差が少ないためです。
以上の実験で、河川水中の有機物を酸化するのに必要な過マンガン酸イオンの量が分かります。
最後にそれを酸素の質量に換算します。
1mol の過マンガン酸イオンが酸素何 mol に相当する働きをするかを考えれば換算することができますね。
過マンガン酸イオンと酸素の半反応式は次のようになります。
| 過マンガン酸イオン | : MnO4- | + 8H+ | + 5e- | → | Mn2+ + 4H2O |
|---|---|---|---|---|---|
| 酸素 | : O2 | + 4H+ | + 4e- | → | 2H2O |
過マンガン酸イオンは 1mol で 5mol の電子を受け取ることができ、酸素は 1mol で 4mol の電子を受け取ることができますね。
したがって、1mol の過マンガン酸イオンは ![]() mol の酸素に相当します。
mol の酸素に相当します。
最後に、COD を測定する例題をやっておきましょう。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

