化学講座 第52回:化学反応速度③素反応以外の反応速度式
素反応でない反応の反応速度式の求め方について説明します。
素反応でない場合は、化学反応式の係数と反応速度式の次数が異なり、反応速度式の次数は与えられたデータから求 めなくてはいけません。大学入学試験ではパターンが 2 つあります。
1)反応物が 1 種類で時間と濃度が与えられている場合
 A → B のように反応物が 1 種類の場合、反応速度式は
A → B のように反応物が 1 種類の場合、反応速度式は ![]() の形になります。このような問題では、時間と濃度の変化を表す右のような表が与えられます。
の形になります。このような問題では、時間と濃度の変化を表す右のような表が与えられます。
ここから反応次数 n と反応速度定数 ![]() を求めましょう。
を求めましょう。
どのように求めるのかと言うと、反応速度式を変形すると
![]() =
= ![]() となります。ここで、
となります。ここで、 ![]() は温度一定なら触媒を加えない限り一定の値になりますので、n の値を 1 , 2 , 3 , ・・・と変化させながら
は温度一定なら触媒を加えない限り一定の値になりますので、n の値を 1 , 2 , 3 , ・・・と変化させながら ![]() の値を計算すればよいのです。そして、
の値を計算すればよいのです。そして、![]() の値が一定になるような n を求めればそれが反応次数になります。
の値が一定になるような n を求めればそれが反応次数になります。
まず、この計算に必要な ![]() と
と ![]() を求めましょう。反応速度は
を求めましょう。反応速度は ![]() でした瞬間の反応速度を求めることは出来ませんから、各時間間隔での平均の反応速度
でした瞬間の反応速度を求めることは出来ませんから、各時間間隔での平均の反応速度 ![]() を用います。また、濃度
を用います。また、濃度 ![]() としても各時間間隔での平均濃度
としても各時間間隔での平均濃度 ![]() を用いることにします
を用いることにします
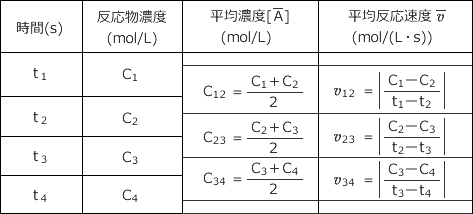
これに対して、![]() を下表のように計算していきます。この中で ① ~ ③ がほぼ一定になるような n がこの反応の反応次数で、その時の
を下表のように計算していきます。この中で ① ~ ③ がほぼ一定になるような n がこの反応の反応次数で、その時の ![]() の平均値が反応速度定数
の平均値が反応速度定数 ![]() です。
です。
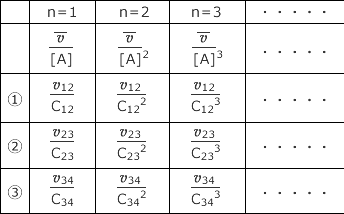
具体的なデータを用いて実際に計算してみましょう。下表に与えられたデータに対して平均濃度と平均の反応速度を計算します。反応速度は正の値になる事に注意してください。
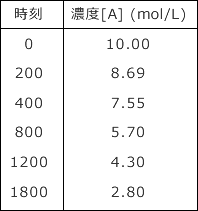
平均濃度と平均の反応速度を計算したのが下表です。
更に、n の値を変化させながら ![]() を計算すると n = 1 でほぼ一定になる事が分かります。n = 2 では全く一定になっていないですね。
を計算すると n = 1 でほぼ一定になる事が分かります。n = 2 では全く一定になっていないですね。
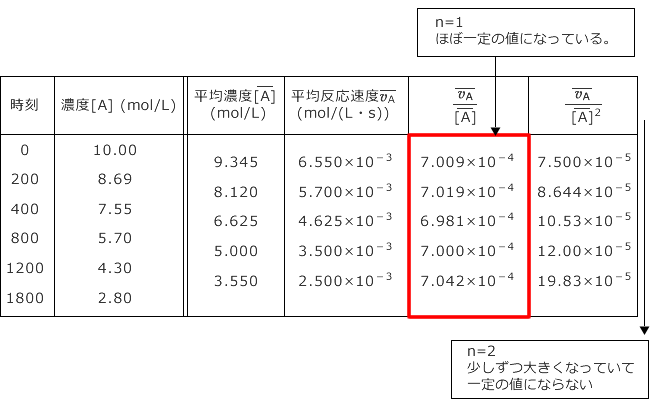
ここから、この反応速度式の次数は 1 であることが分かりますね。
従って、![]() =
= ![]() です。赤枠の中の数の平均値が
です。赤枠の中の数の平均値が ![]() になると考えて、
になると考えて、
![]() =
= ![]() × 10-4 = 7.0102 × 10-4 ≒ 7.01 × 10-4(s)
× 10-4 = 7.0102 × 10-4 ≒ 7.01 × 10-4(s)
よって、この反応の反応速度式は、![]() = 7.01 × 10-4 × [A] と表すことができます。
= 7.01 × 10-4 × [A] と表すことができます。
ところで、反応速度定数は温度一定ならば一定値となりますが、温度を変化させると変化します。
温度を高くすると必ず大きく、低くすると必ず小さくなります。10 ℃ 変化するごとに 2 ~ 3 倍程度になります。
- 問題
下表のデータを見て問いに答えなさい。この反応は途中で温度を変化させたものですが、その時刻はどこでしょうか。また、温度を上昇させたのでしょうか、それとも下降させたのでしょうか。
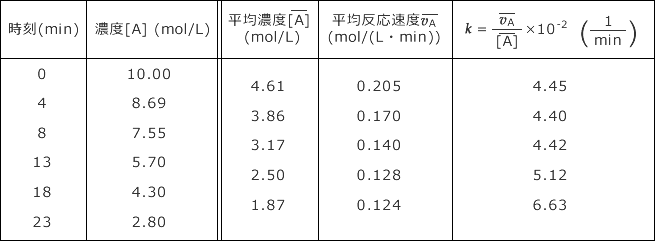
- 解説
反応速度定数kに着目します。時刻 0 min ~ 13 min では 4.45、4.40、4.42 とほぼ同じ値になっていますね。
ところが、13 min ~ 18 min では 5.12 になり、それ以前より 20 % ほど大きくなっています。
従って、温度変化をしたのは 13 min ~ 18 min の間ですね。また、反応速度定数が大きくなっていることから、温度が上昇したことが分かります。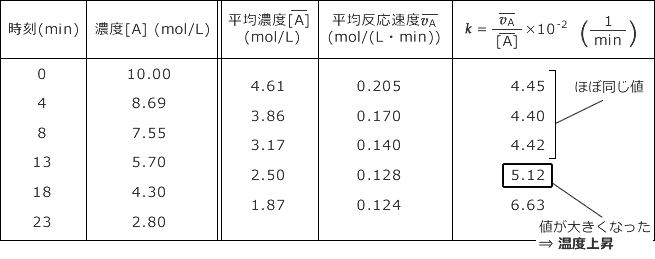
2)反応物が2種類で濃度と反応速度が与えられている場合
aA + bB → C のように反応物が 2 種類の場合、反応速度式は ![]() =
= ![]()
![]() m
m ![]() n の形になります。このような問題では、濃度と反応速度を記した下のような表が与えられます。ここから反応次数 m、n と反応速度定数
n の形になります。このような問題では、濃度と反応速度を記した下のような表が与えられます。ここから反応次数 m、n と反応速度定数 ![]() を求めます。
を求めます。

② → ① の変化を見ると、A の濃度が 2 倍になっていますが、B の濃度はそのままです。一方、反応速度は 4 倍にな
っています。ここから、反応速度は ![]() 2 に比例することが分かります。
2 に比例することが分かります。

② → ③ の変化をみると、B の濃度が 2 倍になっていますが、A の濃度はそのままです。一方、反応速度は 8 倍にな
っています。ここから、反応速度は ![]() 3 に比例することが分かります。
3 に比例することが分かります。

以上から、m=2、n=3となり、反応速度式は ![]() =
= ![]()
![]() m
m ![]() n となります。
n となります。
さて、最後に ![]() を求めます。これは ① ~ ③ のいずれかの値を代入すれば OK です。② を代入してましょう。
を求めます。これは ① ~ ③ のいずれかの値を代入すれば OK です。② を代入してましょう。
![]() よって
よって ![]()
- 問題
-
2A+3B → C という反応において、下表のデータから、この反応の反応速度式を求めよ。
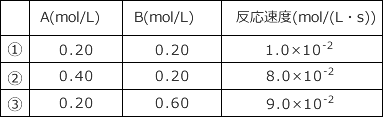
- 解説
反応速度式を
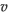 =
= 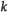
 m
m  n とする。
n とする。
② と ① を比較すると、A の濃度が 2 倍となり、B の濃度が変化していないが、反応速度は 8 倍となっている。
したがって、v は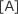 3 に比例する。よって、m = 3
3 に比例する。よって、m = 3
① と ③ を比較すると、A の濃度は変化せず、B の濃度が 3 倍になって反応速度が 9 倍になっている。
したがって、v は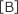 2 に比例する。よって、n = 2
2 に比例する。よって、n = 2以上より、
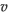 =
= 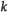
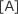 3
3 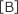 2
2次に
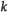 を求めるため、① の値を代入すると、
を求めるため、① の値を代入すると、
1.0 × 10-2 =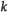 (0.20)3 (0.20)2 =
(0.20)3 (0.20)2 = 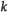 × 32 × 10-5
× 32 × 10-5
よって、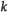 =
= 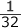 × 103 = 3.125 × 10 ≒ 3.1 × 10 (L4/(mol4・s))
× 103 = 3.125 × 10 ≒ 3.1 × 10 (L4/(mol4・s))以上より、反応速度式は
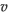 = 3.1 × 10 ×
= 3.1 × 10 × 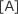 3
3 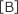 2 ( mol/(L・s) )
2 ( mol/(L・s) )

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

