第29回:電気分解【ファラデーの法則】
- 例題5)
- 0.100mol/L の CuCl2 水溶液1 L を白金電極板を用いて1A の電流で965 秒間電気分解した。このとき、陽極板で発生する気体の標準状態の体積と陰極板に生じる固体の質量、および電気分解後の CuCl2 水溶液の濃度を求めよ。ただし、電気分解の前後で溶液の体積は変化しないものとする。
- (解答)
電気分解も化学反応ですから、反応式を書きます。電気分解は陽極と陰極の2カ所で反応が起こるのでした。そこで、陽極と陰極の両方の反応式を書きます。
CuCl2 の電気分解では陽極で Cl2 が、陰極で Cu が生じます。陽極での反応: 2Cl- → Cl2 + 2e- ・・・・ ① 陰極での反応: Cu2+ + 2e- → Cu ・・・・ ② 全体の反応式(①と②よりe-を消去したもの) : 2Cl- + Cu2+ → Cl2 + Cu ・・・・ ③ この2 つの反応式を使って問題を解くのですが、同じ電気分解槽の陽極と陰極を通過する電子の物質量は同じです。これ、大事な事ですから、注意してくださいね。これを使って問題を解くのです。
では、この電気分解で流れた電子の物質量を求めます。
回路に流れた電気量 = 1 A×965 秒 = 965 C
回路に流れた電子の物質量 =
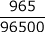 = 0.010 mol
= 0.010 molつまり、陽極にも、陰極にも、0.010 molの電子が流れたのです。これを使って、①、②の式について物質量の比の式を作り、問われている量を求めます。
陽極で発生した Cl2 の標準状態における体積を χℓ とおきます。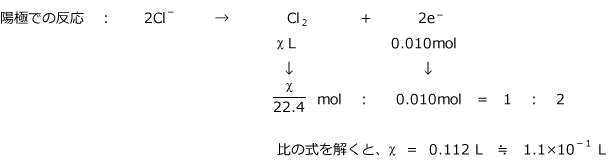
陰極で生じた Cu の質量を yg とおきます。

最後に、③の反応式より、電子 2mol が通過する毎に CuCl2 が 1mol 消費される事が分かります。したがって、この反応により消費された CuCl2 を z mol とすると
e- : CuCl2 の物質量 = 2 : 1 より 0.010 :z = 2 : 1
よって、z=0.0050 mol。電気分解前の CuCl2 水溶液の濃度は 0.10mol/L で体積は 1L なので、CuCl2 は元々0.10mol 存在していた事になります。
したがって、反応後の CuCl2 の物質量は 0.10 - 0.0050 = 0.095mol
よって、電気分解後の CuCl2 の濃度は 0.095mol/L
さらに、もう一問やっておきましょう。今度は、電子の物質量が与えられない問題です。
この問題は、与えられた量から、電子の物質量を求め、それを用いて求めるべき値を計算します。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

