理論化学
無機化学
第7回 アルカリ金属
アルカリ金属(Li,Na,K,Rb,Cs,Fr)
アルカリ金属単体の性質
水素以外の第1族元素をアルカリ金属といいます。アルカリ金属はすべて1個の価電子をもち、1価の陽イオンになりやすく、イオン化エネルギー、電子親和力、電気陰性度が小さな元素です。
この傾向は、原子番号が大きなものほど強くなりますが、それは、原子番号の大きなものほど最外殻電子が原子核から遠くなるためです。
 |  |  |  |  |
| リチウム 融点:180℃ 密度:0.53g/cm3 原子量:6.9 炎色反応:赤色 |
ナトリウム 融点:98℃ 密度:0.97g/cm3 原子量:23.0 炎色反応:黄色 |
カリウム 融点:63℃ 密度:0.86g/cm3 原子量:39.1 炎色反応:紫色 |
ルビジウム 融点:40℃ 密度:1.53/cm3 原子量:85.5 炎色反応:深赤色 |
セシウム 融点:28.4℃ 密度:1.87g/cm3 原子量:133 炎色反応:青紫色 |
アルカリ金属の単体は、どれもやわらかく、ナイフ等の刃物で容易に切断することができます。また、すべて軽金属(4.0g/cm3以下の密度)で密度が小さく、特に、Li、Na、K は水に浮かびます。
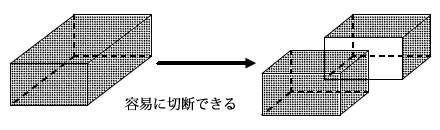 アルカリ金属は軟らかく、Naは竹のヘラでも切断することができます。石油中に保存しておいても、表面は酸化してくすんだ色をしていますが、内部までは酸化されておらず、切断面は金属光沢を持ちます。
アルカリ金属は軟らかく、Naは竹のヘラでも切断することができます。石油中に保存しておいても、表面は酸化してくすんだ色をしていますが、内部までは酸化されておらず、切断面は金属光沢を持ちます。
アルカリ金属の単体は反応性が高く、乾いた空気中でも内部まで容易に酸化されます。
4Na+O2 → 2Na2O
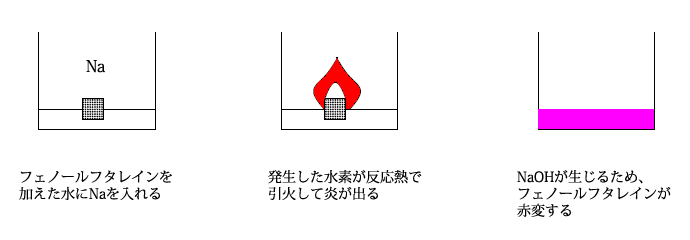
また、常温の水とも激しく反応して水素を発生し、水酸化物になります。この水酸化物は強塩基ですので、反応後の水溶液は塩基性を示します。また、アルコールとも同様の反応をしてアルコキシドを生じます。
- 【水との反応】
- 2Na+2H2O → 2NaOH+H2↑
- 【アルコールとの反応】
- 2Na+2C2H5OH → 2C2H5ONa+H2↑
水との反応では、反応熱で水素が引火し、炎が出たり、爆発をすることがあるので、アルカリ金属の単体は石油中に保存します。Rb、Csは Li、Na、Kに比べて反応性が高いことから、ガラス封管中で保存します。
アルカリ金属は、非常に陽イオンになりやすいため、単体を得ようとして酸化物や塩をコークスを加えて高温にしても還元することはできず、水溶液の電気分解をしても還元することはできません。そのため、アルカリ金属の単体は、塩の融解塩電解によって得ます。
アルカリ金属の化合物
①水酸化ナトリウム
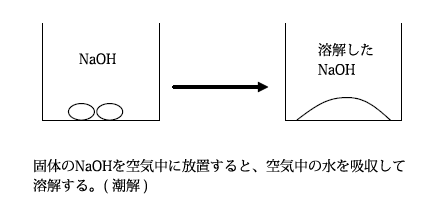
無色の固体で水によく溶けて強い塩基性を示します。結晶を空気中に放置すると、空気中の水を吸収して溶解したり、二酸化炭素を吸収して炭酸ナトリウムになってしまうため、結晶を正確に秤量することができません。
- 【NaOHとCO2の反応】
- 2NaOH+CO2 → Na2CO3+H2O
中和滴定で、滴定のために調製した水酸化ナトリウム水溶液の濃度を、シュウ酸標準水溶液を用いて測定するのはこのためです。
また、このように空気中の水を吸収して溶解することを、潮解といいます。
②炭酸ナトリウムと炭酸水素ナトリウム
炭酸ナトリウムは、ガラス製造の原料として重要な物質で、ソルベー法(アンモニアソーダ法)によって大量に生産されています。
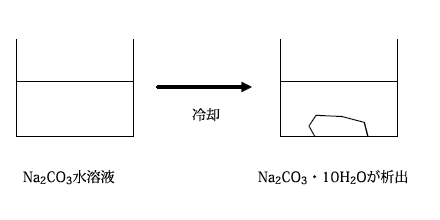
炭酸ナトリウムは白色の粉末ですが、水溶液から炭酸ナトリウムを析出させると、炭酸ナトリウム十水和物の状態で得られます。
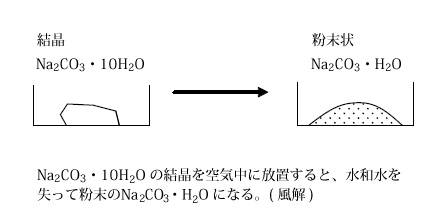
炭酸ナトリウム十水和物は、空気中に放置すると自然と水和水の一部が失われて白色粉末上の炭酸ナトリウム一水和物に変化します。この時、結晶が崩れて粉末になりますが、このような現象を風解といいます。
炭酸ナトリウム水溶液に過剰の二酸化炭素を吹き込むと、水に溶けにくい炭酸水素ナトリウムが沈殿します。
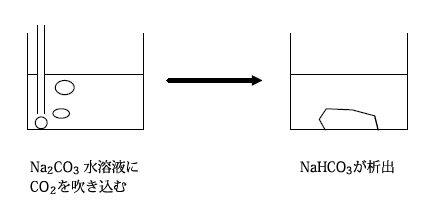
炭酸水素ナトリウムは、白色の粉末で、重曹とも呼ばれます。炭酸水素ナトリウムは加熱すると分解して炭酸ナトリウムを生じますが、この時に二酸化炭素を発生するため、ベーキングパウダーなどに用いられます。
- 【NaHCO3の熱分解】
- 2NaHCO3 → Na2CO3+CO2+H2O
炭酸ナトリウムと炭酸水素ナトリウムは、ともに炭酸のナトリウム塩ですが、水への溶解度が異なり、塩基としての強さも異なるなど、性質に違いがあります。
| 炭酸ナトリウム Na2CO3 | 炭酸水素ナトリウム NaHCO3 | |
|---|---|---|
| 水への溶解 | よく溶ける | すこしだけ溶ける |
| 塩基性 | やや強い塩基性 pH=11~12程度 フェノールフタレインを赤変させる | よわい塩基性 pH=8.0程度 フェノールフタレインを赤変させない |
Na2CO3の製法:ソルベー法
炭酸ナトリウムは、工業的には、CaCO3とNaClを原料に用いたソルベー法(アンモニアソーダ法)で製造されます。
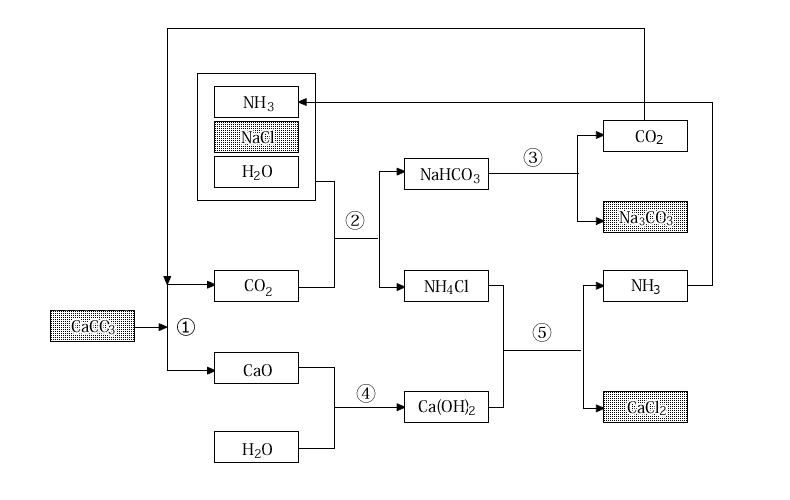
① CaCO3を加熱してCO2 を作る
CaCO3 → CaO+CO2
② ①で得たCO2に、NH3、NaCl、H2Oを加えると、溶解度の低いNaHCO3が沈殿する。
CO2+NH3+NaCl+H2O → NaHCO3+NH4Cl
③ ②で得たNaHCO3を加熱すると、目的とする生成物のNa2CO3が得られる。この際に発生するCO2は回収して、原料として再利用する。
2NaHCO3 → Na2CO3+CO2+H2O
④ ①で生じた CaO にH2Oを加えると強塩基であるCa(OH)2が得られる。
CaO+H2O → Ca(OH)2
⑤ ②で生じたNH4Clに ④で得たCa(OH)2を加えると、弱塩基であるNH3が発生する。
この反応によりNH3の全量が回収できるため、ソルベー法ではNH3は消費されない。
NH4Cl+Ca(OH)2 → CaCl2+2H2O+NH3
①~⑤の反応をすべて合わせると、次の式が得られる。
2NaCl+CaCO3 → Na2CO3+CaCl2





















































