無機化学
第18回 炭素、ケイ素
共有結合性結晶
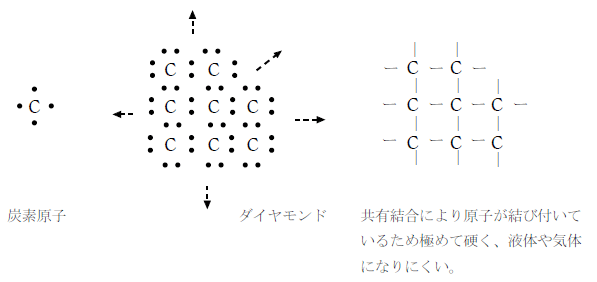
非金属元素のみで構成される物質は、いくつかの原子が共有結合によって結び付いた分子を作り、それらが分子間力によって集まった分子性物質を作るが、炭素やケイ素の単体や一部の化合物は共有結合によって多数がつながり、目に見える大きさの大きな塊となる。これを共有結合の結晶という。
共有結合の結晶は弱い分子間力ではなく、強い共有結合によって作られるため、沸点や融点が極めて高く溶媒に溶けない、また、硬い物質が多い。
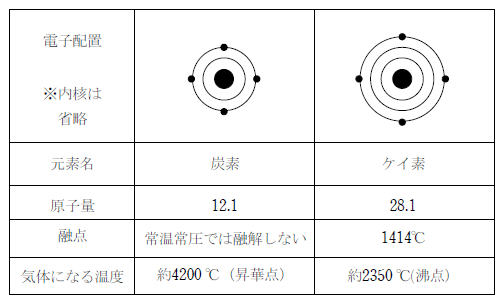
炭素の単体は常温常圧では融点が無く約4200℃で昇華するが、これは気体になる温度としては全物質中最も高い温度である。
【分子性物質:酸素】

【共有結合の結晶:ダイヤモンド】
分子性物質と共有結合の結晶の性質の違い
| 分子性物質 | 共有結合の結晶 | |
|---|---|---|
| 結合の種類 | 【分子内】共有結合 【分子間】ファンデルワールス力 水素結合 |
共有結合 |
| 硬さ | やわらかくもろい | 硬い |
| 融点・沸点 | 低い | 高い |
| 電気伝導性 | 【固体】なし 【液体・水溶液】電離するものはあり |
【ダイヤモンド】なし 【グラファイト】あり 【ケイ素】半導体 |
※共有結合の結晶には、炭素の単体(ダイヤモンド、グラファイト)ケイ素の単体、二酸化ケイ素 (SiO2) 、カーボランダム (SiC) 等がある。
炭素
炭素の性質
炭素は価電子数が4で原子1つあたり最大4本の共有結合を作る。そのため、炭素と炭素の結合には、単結合、二重結合、三重結合の3種類がある。
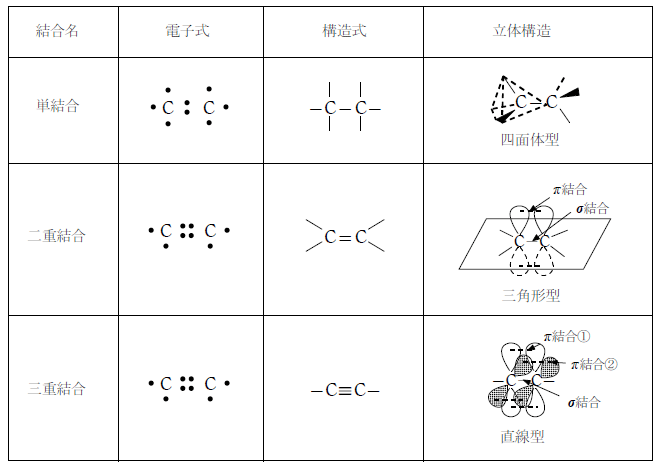
※二重結合はσ結合1本とπ結合1本、三重結合はσ結合1本とπ結合2本からなる。
※結合の長さは 単結合>二重結合>三重結合 の順である。
炭素の単体
炭素の単体には、ダイヤモンド、グラファイト(黒鉛)、無定形炭素がある。ダイヤモンドとグラファイトは結合に二重結合や三重結合を含まず、単結合のみで構成される。
1)ダイヤモンド
炭素原子が価電子4つをすべて使い、4つの炭素原子と結合して生じる共有結合性結晶。気体になる温度(昇華点)が物質中最も高く、硬さ(モース硬度)が単体中で最も大きい。無色透明で、自由電子がないため電気伝導性を持たない。
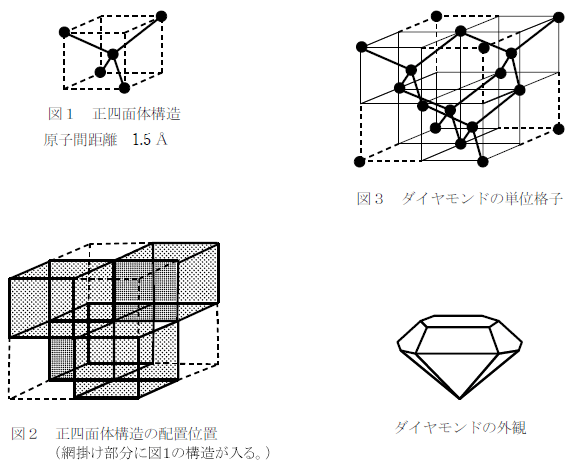
単結合のみをする炭素は正四面体の頂点方向に結合の手を伸ばすので、ダイヤモンドの結晶構造は下図1のように正四面体構造となる。
この正四面体構造を、下図2の色を塗った部分に配列したものがダイヤモンドの単位格子で、原子の位置を書くと下図3のようになる。
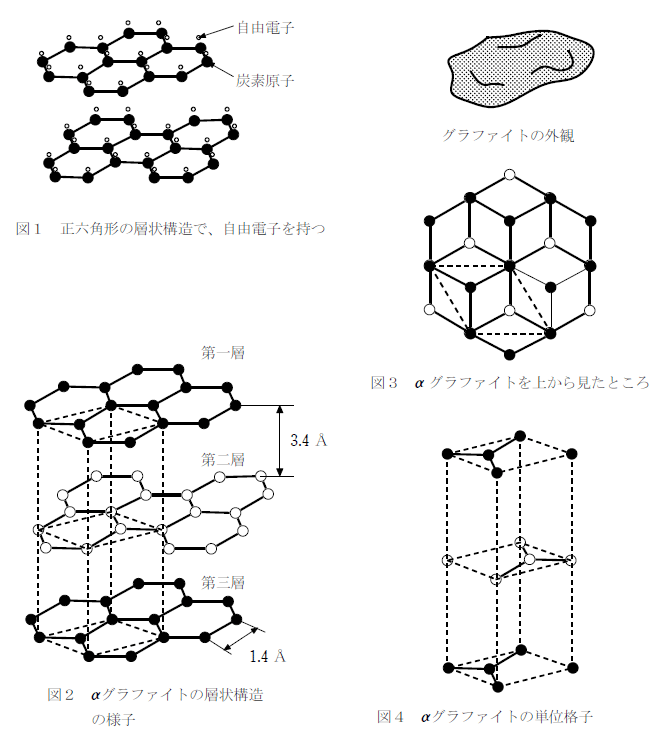
2)グラファイト
炭素原子が価電子のうち 3 つを用いて 3 個の炭素原子と結合をして生じる共有結合性物質で、六角形型のシート状の高分子がファンデルワールス力によって重なってできる。層を構成する炭素原子間の結合は強い共有結合だが、層と層の間には弱いファンデルワールス力によって結びついているだけなので、ダイヤモンドと違い、軟らかくてもろく、衝撃を加えると割れてしまう。また、分子間力による結合は共有結合による結合よりも距離が長くなるため、黒鉛はダイヤモンドより密度が小さい。
価電子のうち結合に用いられない 1つは自由電子となり、自由に層上を動くことができるため電気伝導性があり、金属光沢をもつ。
黒鉛の結晶構造には重なり方の違いで α型とβ型があるが、ほとんどが下図に示すα型である。αグラファイトは第一層と第三層が重なり、その間に第二層が入り込んだ形をしている。
3)無定形炭素
無定形炭素はダイヤモンドでもグラファイトでもない炭素の単体の総称で、決まった結晶構造を取らない。カーボンナノチューブやフラーレンなどは無定形炭素に含まれる。物質としてはススやコークス(石炭を乾留して不純物を除いたもの)などがある。
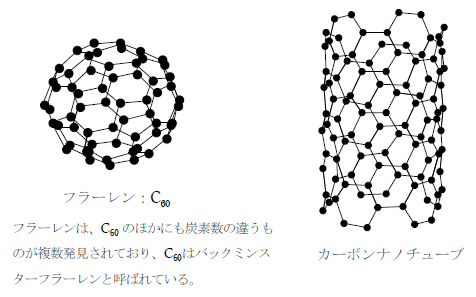
①フラーレン
炭素原子60個からなるバックミンスターフラーレンは、6員環が20、5員環が12、単結合60本、二重結合30本からなる安定な構造である。フラーレンには、このほかに炭素数が、70、74、76、78のものなどが発見されている。
フラーレンは遺伝子操作の際のDNAの運搬、化粧品などに応用されているほか、HIVの治療薬、半導体材料などへの応用が研究されている。
②カーボンナノチューブ
グラファイトの層構造(グラフェンシート)を丸めたような形をしている。溶媒に溶けにくく、高い導電性、熱伝導性、耐熱性を持ち、樹脂、合成ゴム、インク、塗料、半導体、光学機器や構造材料など、幅広い用途への応用が見込まれている。
炭素の化合物
1)一酸化炭素
常温常圧で無色・無臭の可燃性気体。呼吸によって体内に取り込むと、血液中のヘモグロビンと強く結びついて酸素の運搬を妨げるため人体に有毒である。高温では強い還元作用を示し、鉄や銅などの精錬に用いられる。
赤鉄鉱の還元: Fe2O3 + 3CO → 2Fe + 3CO2
一酸化炭素は酸素が不十分な環境で有機物を燃焼させると発生するほか、実験室ではギ酸に濃硫酸を作用させることで得られる。これは濃硫酸の脱水作用によるものである。工業的には加熱したコークスと水蒸気を反応させて得る。
ギ酸と濃硫酸の反応:HCOOH → CO + H2O
コークスと水蒸気の反応: C + H2O → CO + H2
2)二酸化炭素
常温常圧で無色・無臭の気体、一酸化炭素と異なり燃焼しない。固体はドライアイスと呼ばれ、常温常圧で昇華する性質を持つ。低濃度では毒性を持たないが、濃度が高くなると頭痛、めまい、吐き気等を催し、7%以上の場合数分程度で意識を失う。
ただし、高校化学の範囲では毒性がないと記述される。
高温でコークスと反応させると一酸化炭素を生じる。コークスがない場合は一酸化炭素と酸素に分解する可逆反応を起こす。
コークスと二酸化炭素の反応: C + CO2 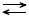 2CO
2CO
二酸化炭素の熱分解: 2CO2 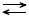 2CO + O2
2CO + O2
石灰水(水酸化カルシウムの飽和水溶液)に通じると水に不溶の炭酸カルシウムの微粒子が生じ白濁するが、通じ続けると水に通うな炭酸水素カルシウムとなって透明になる。この水溶液を加熱すると再び白濁する。
石灰水へ二酸化炭素を通じる:Ca(OH)2 + CO2 → CaCO3 + H2O
二酸化炭素を通じ続ける: CaCO3 + CO2 + H2O → Ca(HCO3)2
透明になった水溶液を加熱する:Ca(HCO3)2 → CaCO3 + CO2 + H2O
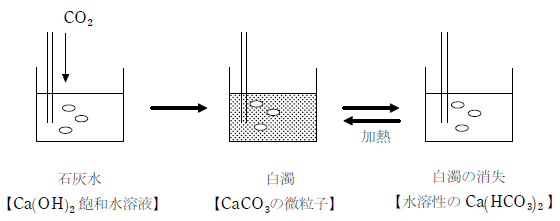
二酸化炭素は有機物の燃焼で生じるほか、工業的には炭酸カルシウムの熱分解により得る。
炭酸カルシウムの熱分解:CaCO3 → CaO + CO2
3)炭酸
二酸化炭素を水に溶かすと、その大部分が反応して炭酸が生じる。
CO2 + H2O → H2CO3
生体中では炭酸と炭酸水素イオンが平衡状態となって緩衝作用を示す。これは生体の血液のpHを一定に保つために非常に重要である。
H2CO3 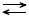 HCO3- + H+
HCO3- + H+
4)有機化合物
炭素は共有結合によって次々と繋がっていく性質がある。炭素が結合してできた構造を基本骨格とする化合物を有機化合物という。有機化合物を構成する元素は炭素、水素、酸素、窒素、ハロゲンなど少ない種類の元素からなるが、炭素の結合の多様性と枝分かれなどの構造が無数に存在するため非常に多くの化合物が存在する。
ケイ素
ケイ素の単体と性質
ケイ素の単体は、ケイ素原子が 4 つの価電子全てを用いて 4 つのケイ素原子と共有結合してできるダイヤモンド型の結晶構造を取る。単体は銀白色で自由電子は持たないが、導体と不導体の中間の電気伝導性を持つため半導体と呼ばれる。また、金属光沢をもつことなどから半金属に分類される事もある。
ケイ素は地殻中に最も多く含まれる元素であるが、単体で産出することは無く、通常は二酸化ケイ素 ( SiO2 ) の形で産出する。
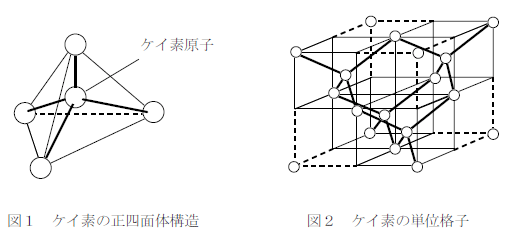
二酸化ケイ素
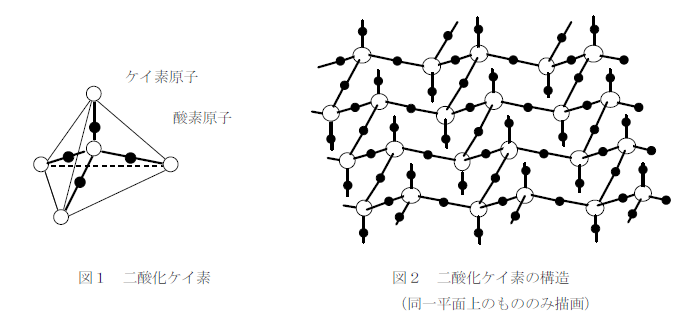
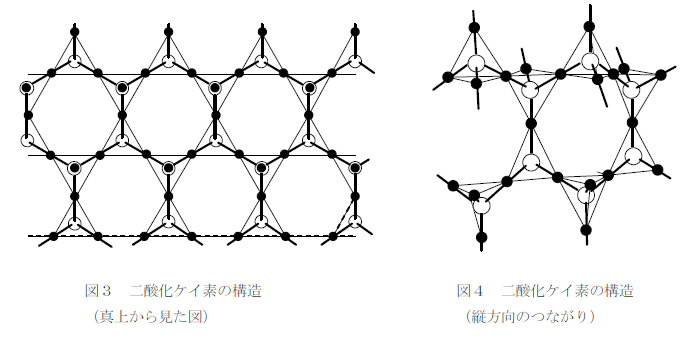
二酸化ケイ素は鉱物名を石英といい、岩石や砂の主成分である。純粋なものを水晶という。結晶構造はダイヤモンドやケイ素と同じ正四面体で、共有結合により強固に結合しているため、酸性酸化物であるにもかかわらず水に不溶である。
下図に二酸化ケイ素の構造を示す。図1のように隣り合う正四面体構造は上下さかさまになっている。これを真上から見た図が図2で、縦方向のつながりを示したのが図3である。
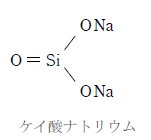
SiO2 に NaOH や Na2CO3 のような塩基を加えて強熱するとケイ酸ナトリウムが生じる。
ケイ酸ナトリウムは下図の構造を持ち、水に溶ける。ケイ酸ナトリウムの濃厚水溶液は粘性があり、水ガラスという。
ケイ酸とNaOHの反応:SiO2+2NaOH → Na2SiO3 + H2O
ケイ酸とNa2CO3の反応:SiO2+Na2CO3 → Na2SiO3 + CO2
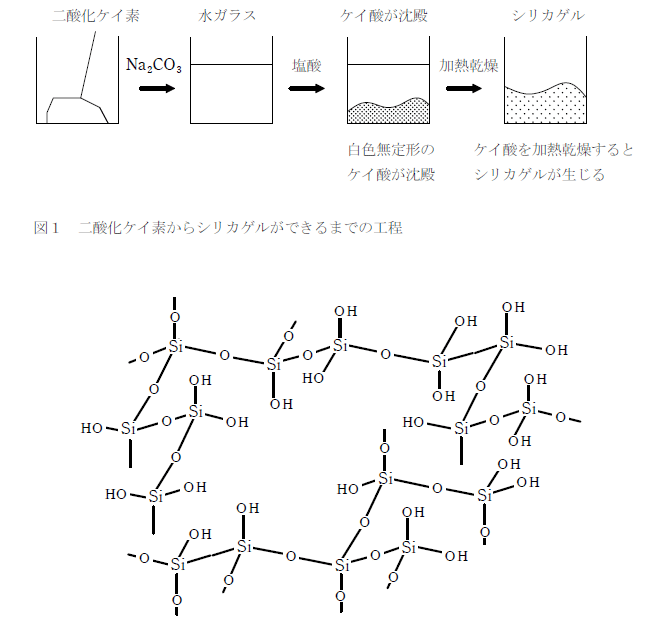
水ガラスに塩酸を加えると、ケイ酸と水が結びついた繊維状の沈殿が生じる。この沈殿は熱水やアルカリにはとけるが、冷水にはほとんど溶けない。
水ガラスと塩酸の反応:Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
ケイ酸を加熱乾燥してできるキセロゲルはシリカゲルといい、多孔質で内部に多数のヒドロキシ基を持つため吸湿性をもち、乾燥剤として利用される。
ガラス
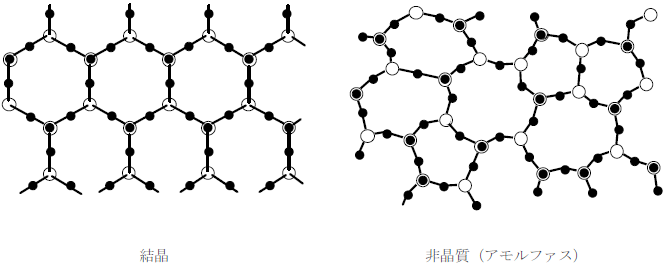
固体には原子や分子が整然と配列された結晶と、ランダムな配列を持つ非晶質(アモルファス)がある。
ガラスには2つの意味があり、1つはこの非晶質状態を表す場合である。金属、非金属を問わず幅広い物質でこの非晶質の状態が存在する。もう1つはケイ酸塩を中心とする物質で、ここでは後者について説明する。
ガラスは古くから様々な用途に用いられており、例えば、石器時代には溶岩が冷却されて固まったガラス(黒曜石)が矢じりや刃物として利用されていたし、紀元前4000年ごろにはメソポタミアで装飾品としてビーズ状のガラスが製造されるようになったが、大量の燃料が必要で製造工程が複雑であり、宝石と同様に高価なものだった。
紀元前1世紀になるとエジプトのアレクサンドリアで宙吹き法(パイプの先端に熱したガラスを付着させ、息を吹き込んで円形に成型する方法)が開発され、大幅な製造コストダウンに成功し、一般に普及する程度に価格が下落した。これはローマ帝国全域に伝わり、ローマガラスと呼ばれた。
日本へのガラス伝来は古墳時代と言われており、西アジア(ササン朝)製のカットグラスが大阪の高屋築山古墳(6世紀ごろ)から出土している。
その後、ローマ帝国の衰退により8世紀ごろまで西ヨーロッパでのガラス製造は衰退するが、5世紀ごろにシリアで平板ガラスの製造法が開発されるなど、各地で技術革新が進められた。その後、8世紀ごろの彩色技法、12世紀ごろのステンドグラス、13世紀の透明ガラス、15世紀のクリスタルガラスなど様々なガラスが開発され用いられた。
これ以上の詳しい歴史についてはここでは触れないが、現代では様々なガラスが開発され、食器や窓ガラスから機能性材料まで様々な用途で用いられている。
高校化学では次のようなガラスを学習する。ガラスの主成分は SiO2 であるが、純粋な SiO2 は融点が高く、成型に大きなコストがかかる。そこで、Na2CO3 や K2CO3 のような塩基を加えて共有結合を一部切断し、融点を下げたガラスがソーダ石灰ガラス、カリ石灰ガラスである。これらは窓ガラスや食器などに用いられる。
鉛 (PbO) を加えたガラスが鉛ガラスである。透明度が高く、クリスタルガラスとも呼ばれる。日本でも江戸切子として知られている。放射線を遮蔽する性質があり、X線室の窓などに用いられる。
B2O3 を加えたガラスはホウケイ酸ガラスと呼ばれ、熱や薬品に強く、耐熱ガラスや理科学機器に用いられる。パイレックスとも呼ばれるが、これは商品名である。
純粋な SiO2 でできたガラスは石英ガラスと呼ばれる。熱や薬品に強く、ホウケイ酸ガラスと同様に理化学機器に用いられるほか、屈折率が大きいことから光ファイバーなどにも用いられる。
| 名称 | SiO2以外の成分 | 用途、性質など |
|---|---|---|
| カリ石灰ガラス | CaCO3 Na2CO3 |
窓ガラス、食器などに用いられる。最も古くから用いられているガラスである。 |
| ソーダ石灰ガラス | CaCO3 K2CO3 |
窓ガラス、食器などに用いられる。ソルベー法により Na2CO3 が安価に生産されるようになり普及した |
| 鉛ガラス | CaCO3 PbO |
鉛を含むガラスは美しい透明度を持つため、クリスタルガラスとして食器や装飾品などに用いられる。鉛の含有率が高いものは放射線を遮蔽する性質があるので放射線遮蔽ガラスとして用いられる。 |
| ホウケイ酸ガラス | B2O3 | 熱や薬品に強いため、耐熱ガラスや理化学機器(ビーカー等)に用いられる。パイレックスとも呼ばれる。 |
| 石英ガラス | なし | 熱や薬品に強く非常に透明なため理化学機器(ビーカー等)に用いられる。また、屈折率が大きく、全反射をさせやすいため光ファイバーにも用いられる。 |
土器、陶器、磁器
粘土を加熱すると、粘土の粒子の間にある水分や不純物が除去されて徐々に粘土同士が結びつく。これを焼成といい、粘土の粒子の大きさがそろっているほど、純度が高いほど、また、焼成する温度が高いほど密度の高い固体が得られる。
このようにして得られた固体を陶磁器という。
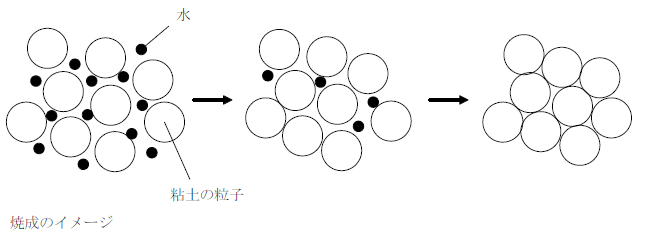
陶磁器には土器、陶器、磁器の3種類があり、土器は形成した粘土を窯を使わずに直火で焼成する。土器は隙間が多く、水分を吸収する。土器より純度の高い粘土を用い、窯を使って高温で焼き上げるのが陶器である。土器よりは少ないが隙間が多く、水分を吸収する。陶器は陶石を砕いて作った粉末を水や粘土と混ぜた原料を高温の窯で焼いたものである。たたくと金属音のような高い音がする。密度が高く、隙間が小さく、ほとんど水分を吸収しない。

セメント
セメントは一般的には水や液剤などにより水和や重合をし、硬化する粉体のことを指す。ここでは、それらのセメントのうち大学入試で出題されるものとして、モルタルやコンクリートとして使用されるポルトランドセメントについて解説する。
ポルトランドセメントは、SiO2 、CaO、Al2O3 、Fe2O3 からなる物質で、水を加えてかき混ぜると水和反応により硬化する。
コンクリートはポルトランドセメントに砂を加えたものである。これらは圧縮には非常に強いが引っ張る力や横方向にずらす力には弱く、容易に破壊されてしまう。そのため、建築材料として用いる場合は鉄筋を入れて横方向への力や引っ張る力に耐えられるようにしている。
構成する物質が塩基性であるため、酸に弱く、酸性雨などにさらされると徐々に溶解していく。





















































