理論化学
無機化学
第10回 両性元素(Zn、Sn、Pb)
亜鉛(Zn)
亜鉛は、銀白色の金属(軽金属ではない)で、イオン化傾向は比較的大きいが、ZnS(閃亜鉛鉱)を酸化して酸化亜鉛とした後に炭素で還元することで単体を得ることができる。
2ZnS+3O2→2ZnO+2SO2↑
ZnO+C→Zn+CO↑
または2ZnO+C→Zn+CO2↑
(*閃亜鉛鉱はZnSであるため本来白色または透明であるが、不純物として含まれる鉄により黒色となる。)
亜鉛を空気中で燃焼させると、酸化亜鉛ZnOを生じる。酸化亜鉛は白色顔料として絵の具などに用いられる。
2Zn+O2→2ZnO
亜鉛は両性金属で酸にも強塩基の水溶液にも水素を発生して溶ける。
Zn+2HCl→ZnCl2+H2↑
Zn+2NaOH+2H2O→Na2[Zn(OH)4]+H2↑
酸化亜鉛、水酸化亜鉛も両性化合物であり、酸にも強塩基の水溶液にも溶解する。
ZnO+2HCl→ZnCl2+H2O
ZnO+2NaOH+H2O→Na2[Zn(OH)4]
Zn(OH)2+2HCl→ZnCl2+2H2O
Zn(OH)2+2NaOH→Na2[Zn(OH)4]
また、亜鉛のイオンを含む水溶液をアルカリ性にすると白色の沈殿Zn(OH)2が発生するが、ここに過剰のNaOHまたは過剰のアンモニアを加えると沈殿が溶解する。
Zn2++2OH-→Zn(OH)2
Zn(OH)2+2NaOH→Na2[Zn(OH)4]
Zn(OH)2+4NH3→[Zn(NH3)4](OH)2
亜鉛の錯イオンは4配位型であるが、銅やアルミニウムと異なり正四面体型をしていることに注意。
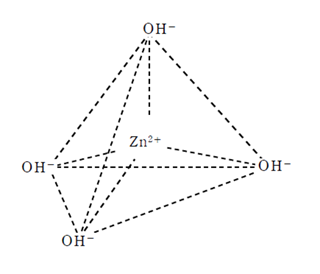
テトラヒドロキソ亜鉛(Ⅱ)酸イオン
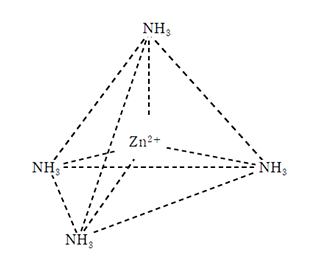
テトラアンミン亜鉛(Ⅱ)イオン
亜鉛のイオンを含む水溶液を塩基性にした後H2Sを通じると、白色の沈殿(ZnS)が生じる。
Zn2++S2-→ZnS
鉄の表面に亜鉛をメッキしたものをトタンといい、銅と亜鉛の合金をしんちゅうという。亜鉛は軟らかい金属であるが、トタンは屋外で使われる。これは、亜鉛の方が鉄よりもイオン化傾向が大きいため、傷がついた時に亜鉛が先に腐食(酸化)され、鉄が腐食されにくいためである。
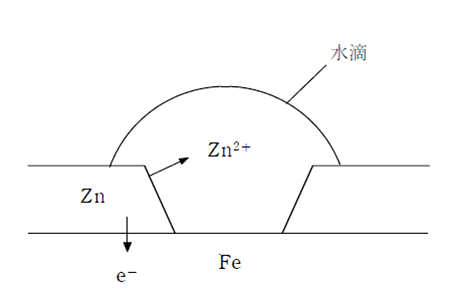
イオン化傾向の大きな Zn から小さなFe へ電子が流入し、Zn はイオン化されるが、Fe はイオン化されない。
Zn の関連図と化学反応式
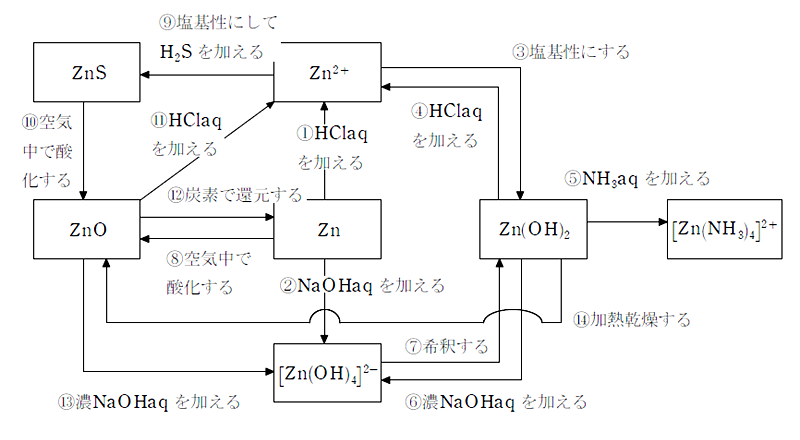
化学反応式
- ① Zn+2HCl→ZnCl2+H2↑
- ② Zn+2NaOH+2H2O→Na2[Zn(OH)4]+H2↑
- ③ Zn2++2OH-→Zn(OH)2
- ④ Zn(OH)2+2HCl→ZnCl2+2H2O
- ⑤ Zn(OH)2+4NH3→[Zn(NH3)4](OH)2
- ⑥ Zn(OH)2+2NaOH→Na2[Zn(OH)4]
- ⑦ Na2[Zn(OH)4]→Zn(OH)2+2NaOH
- ⑧ 2Zn+O2→2ZnO
- ⑨ Zn2++S2-→ZnS
- ⑩ 2ZnS+3O2→2ZnO+2SO2↑
- ⑪ ZnO+2HCl→ZnCl2+H2O
- ⑫ ZnO+C→Zn+CO↑または2ZnO+C→Zn+CO2↑
- ⑬ ZnO+2NaOH+H2O→Na2[Zn(OH)4]
- ⑭ Zn(OH)2→ZnO+H2O
スズ(Sn)
スズは銀白色の金属で、イオン化傾向が小さく、常温でも比較的安定でさびにくい。イオンには+Ⅱのものと+Ⅳのものがあるが、+Ⅳのものの方がはるかに安定であるため、SnCl2 は強い還元性を示す。 ニトロベンゼンからアニリン塩酸塩を合成する時に HCl と Sn を用いるのは、Sn と HCl の反応によって生じる Sn2+による還元作用を利用するためである。
スズ(Ⅱ)イオンの還元剤としての半反応式:Sn2+→Sn4++2e-
ニトロベンゼンの酸化剤としての半反応式: C6H5NO2+6H++6e-→C6H5NH2+2H2O
スズ(Ⅱ)イオンによるニトロベンゼンの還元反応の半反応式
C6H5NO2+3Sn2++6H+→C6H5NH2+2H2O+3Sn4+
この反応式とSn+2HCl→Sn2++2Cl-+H2↑を組み合わせると、下の式が得られる。スズと濃塩酸によるニトロベンゼンの還元反応の化学反応式
C6H5NO2+3Sn+13HCl→C6H5NH3Cl+2H2O+3SnCl4+4H2↑
両性金属であり、酸にも強塩基の水溶液にも水素を発生して溶ける。スズはアルミニウムや銅と同じ四配位型の錯イオンを作る。
Sn+2HCl→2nCl2+H2↑
Sn+2NaOH+2H2O→Na2[Sn(OH)4]+H2↑
鉄の表面にスズをメッキしたものをブリキという。スズは硬い金属であるが、ブリキは屋外ではあまり使われない。これは、スズの方が鉄よりもイオン化傾向が小さいため、傷がついたときに鉄の方が先に腐食(酸化)されてしまうためである。
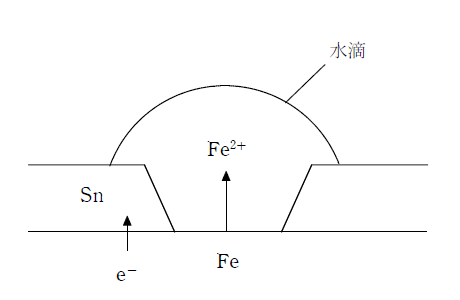
イオン化傾向の大きな Fe から小さなSn へ電子が流入し、Fe はイオン化されるが、Sn はイオン化されない。
Zn の関連図と化学反応式
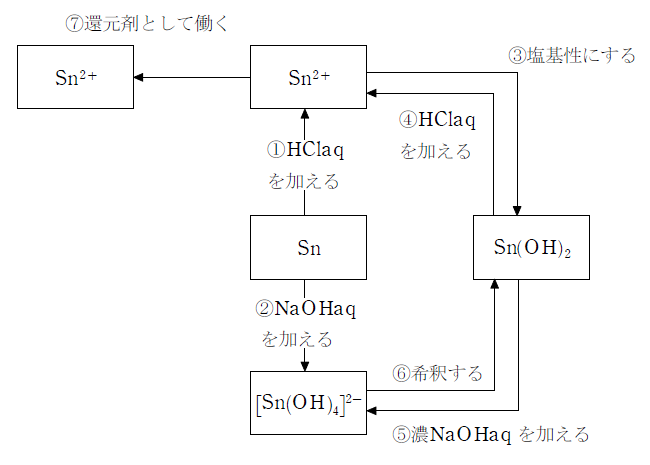
化学反応式
- ① Sn+2HCl→SnCl2+H2↑
- ② Sn+2NaOH+2H2O→Na2[Sn(OH)4]+H2↑
- ③ Sn2++2OH-→Sn(OH)2
- ④ Sn(OH)2+2HCl→SnCl2+2H2O
- ⑤ Sn(OH)2+2NaOH→Na2[Sn(OH)4]
- ⑥ Na2[(Sn(OH)4]→Sn(OH)2+2NaOH
- ⑦ Sn2+→Sn4++2e-
鉛(Pb)
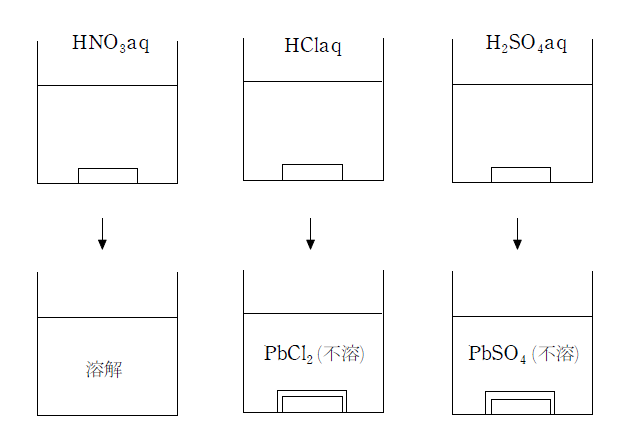
鉛は、灰色の金属光沢を持ち、軟らかくて密度の大きい金属である。水素よりイオン化傾向が大きいので酸に溶ける。しかし HClaq とH2SO4aq には表面に水に不溶の塩であるPbCl2 やPbSO4 を生じるため溶解しない。
鉛はX線などの放射線を吸収する能力を持つため、放射線の遮蔽板として用いられることもある。また、鉛には+Ⅱと+Ⅳの化合物があるが、このうち+Ⅱの方が安定であるので、酸化鉛(Ⅳ)や酢酸鉛 (Ⅳ) には酸化力がある。 これを利用して酸化鉛(Ⅳ)は鉛蓄電池の正極に用いられる。
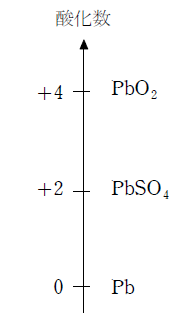
鉛蓄電池の正極での反応
PbO2+SO42-+4H++2e-→PbSO4+2H2O
鉛蓄電池の負極での反応
Pb+SO42-→PbSO4+2e-
Pb2+ は沈殿を作りやすく、塩化物イオン、硫酸イオンのほか、クロム酸イオンや硫化物イオンと沈殿を作る。(このうち、PbCl2 は熱湯に溶ける。)
Pb2++2Cl-→PbCl2(白)
Pb2++SO42-→PbSO4 (白)
Pb2++CrO42-→PbCrO4 (黄)
Pb2++S2-→PbS (黒)
また、鉛とスズの合金をハンダといい、電気回路の接着剤等として用いられている。
Zn の関連図と化学反応式
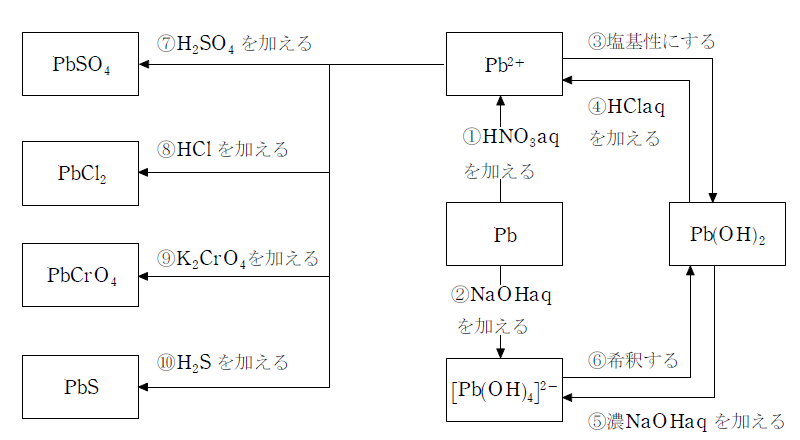
化学反応式
- ① Pb+2HNO3→Pb(NO3)2+H2
- ② Pb+2NaOH+2H2O→Na2[Pb(OH)4]+H2
- ③ Pb2++2OH-→Pb(OH)2
- ④ Pb(OH)2+2HCl→PbCl2+2H2O
- ⑤ Pb(OH)2+2NaOH→Na2[Pb(OH)4]
- ⑥ Na2[Pb(OH)2]→Pb(OH)2+2NaOH
- ⑦ Pb2++SO42→PbSO4(白)
- ⑧ Pb2++2Cl-→PbCl2(白)
- ⑨ Pb2++CrO42-→PbCrO4(黄)
- ⑩ Pb2++S2-→PbS(黒)





















































