無機化学
第19回 酸素
酸素
酸素の性質
酸素は第十六族に属する非金属元素で、最外電子殻に6個の電子を持ち2価の陰イオンになりやすい。地殻中に最も多く含まれる元素である。単体には 2 原子分子の酸素と、3原子分子のオゾンが存在する。
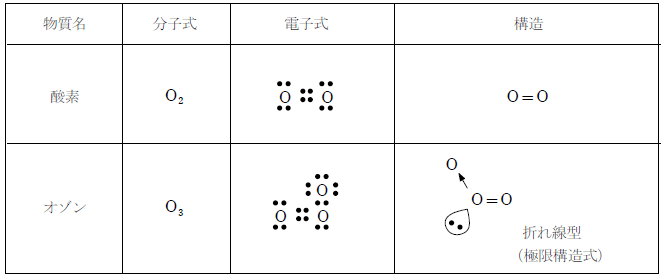
酸素は二重結合による2原子分子であるが、オゾンは二重結合と配位結合による3原子分子である。しかし、オゾンの結合は、等価な1.5重結合2本であることが知られている。
これについて詳しく説明しよう。
共鳴構造による考え方
中心の酸素に結びつく2つの酸素原子は等価なので、実際は二重結合と配位結合がきわめて短い時間で入れ替わっていると考えられる。
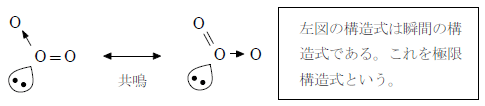
この入れ替わりの速度は非常に速く、実際は下図に示すように硫黄原子と酸素原子の結合は単結合と二重結合の中間程度(1.5重結合)になっていると考えられる。
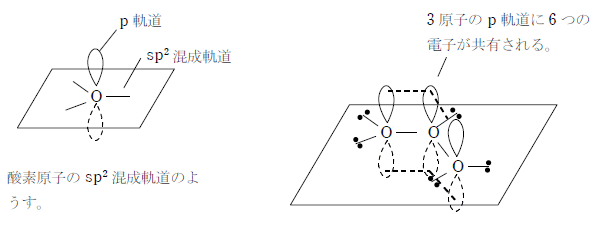
π電子の非局在化による考え方
3つの酸素原子がそれぞれ sp2 混成軌道を形成することで、酸素原子のp軌道が全てつながって、そこに6つの電子が共有される。これにより、酸素原子と酸素原子の間に存在する電子は平均3個となり、結合は1.5 重結合となる
1)酸素
単体の酸素は大気中に体積百分率で約21%存在する。助燃性(物質を燃やす性質)があり、火のついた線香を純粋な酸素中に入れると激しく燃焼する。
地球上には本来、単体の酸素は数%程度しか存在しなかったが、約25億年ほど前に起こった地殻変動により光合成をするシアノバクテリアが劇的に増加したことで急激に増えたと考えられている。
【光合成の式】 6CO2 + 6H2O → C6H12O6 + 3O2
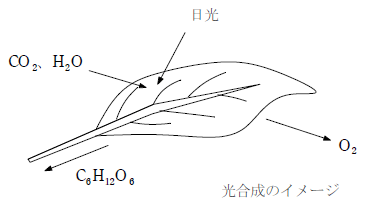
これにより、地球上では酸素を利用した好気呼吸をする生物が増加した。好気呼吸は嫌気呼吸に比べて多くのATPを作り出すことができるため、この酸素の劇的な増加がその後の生物多様性を産み出すきっかけとなった。
酸素の製法
酸素は工業的には液体空気の分留により得る。実験室では次の 2 つのいずれかの方法で得る。
1)二酸化マンガンを触媒とする過酸化水素の分解
過酸化水素に二酸化マンガンを加えると、二酸化マンガンが触媒として働き過酸化水素が分解されて酸素が発生する。
2H2O2 → 2H2O + O2
この反応は、H2O2 が酸化剤と還元剤の両方として働く自己酸化還元反応である。
半反応式)H2O2 + 2H+ + 2e- → 2H2O
H2O2 → O2 +2H+ + 2e-
全反応式)2H2O2 → O2 + 2H2O
2)二酸化マンガンを触媒とする塩素酸カリウムの熱分解
塩素酸カリウムに二酸化マンガンを加えて加熱すると、二酸化マンガンが触媒として働き塩素酸カリウムが分解されて酸素が発生する。
2KClO3 → 2KCl + 3O2
この反応は次の 2 段階で起こる反応である。
【塩素酸カリウムの自己酸化還元反応による過塩素酸カリウムの生成】
塩素酸カリウムは酸化剤、還元剤の両方として働く。塩素酸カリウムを加熱すると、次の反応が起こる。
半反応式)KClO3 + 6H+ + 6e- → KCl + 3H2O ・・・ ①
KClO3 + H2O → KClO4 + 2H+ + 2e- ・ ・ ・ ②
全反応式)①+②×3より
4KClO4 → 3KClO4 + KCl ・・・ ③
【過塩素酸カリウムの分解】
過塩素酸カリウムは過熱により次の反応により分解する。
KClO4 → KCl + 2O2
これを④へ代入すると、4KClO3 → 4KCl + 6O2 が得られる。
この反応は触媒として二酸化マンガンが存在すると 70℃程度でもよく進むので、実験室で酸素を生成する際に用いられる。
2)オゾン
オゾンは酸素原子 3 つが結び付いてできる化合物で、特異臭、淡青色の気体である。フッ素に次ぐきわめて強い酸化力があり、それを利用した殺菌漂白作用を示すことから殺菌や有機物の除去などにも用いられる。日本でも空気清浄機、食品や水道水の殺菌からガンやリウマチの治療まで幅広く応用されている。オゾンは有毒な気体だが、極めて不安定で速やかに酸素になることから残留しにくく、使用した場合の環境負荷が小さいのも特徴である。
【オゾンの酸化剤としての半反応式】
(酸性条件) O3 + 2H+ + 2e- → H2O + O2
(中性・塩基性条件) O3 + H2O + 2e- → 2OH- + O2
有機化学では炭素間の二重結合を酸化開裂する目的で用いられる。生じる物質はカルボニル化合物である。この操作をオゾン分解といい、構造決定問題でよく出題される。
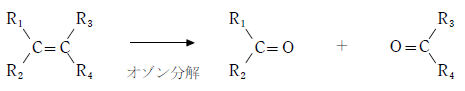
オゾンは酸素に紫外線や無声放電を加えると発生する。自然界では高度10km~50kmの付近に多く存在し、オゾン層と呼ばれる。オゾン層では酸素分子が紫外線を吸収してオゾンを生成する反応と、オゾン分子が紫外線を吸収して酸素を生成する反応が同時に起こっており、これにより地表に届く紫外線が減少する。
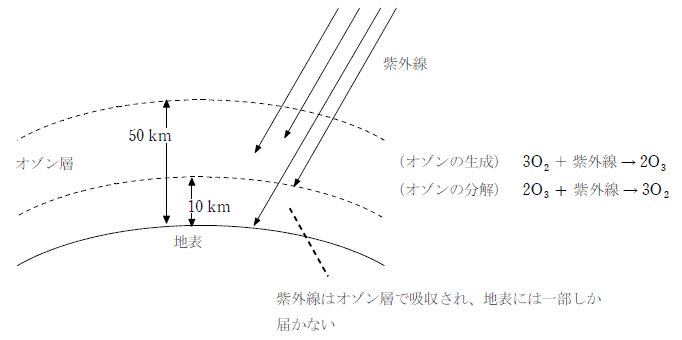
オゾンは塩素化合物などの存在により分解される。工場や家庭用エアコンなどの熱媒体として塩素化合物のフロンが盛んに使用された時期がある。このフロンが大気中に放出されることでオゾン層の破壊が進み、穴が開いて(オゾンホール)地表に届く紫外線量が問題となった時期があった。現在はフロンの使用が規制されており、それに伴ってオゾン層は回復しつつあると言われている。
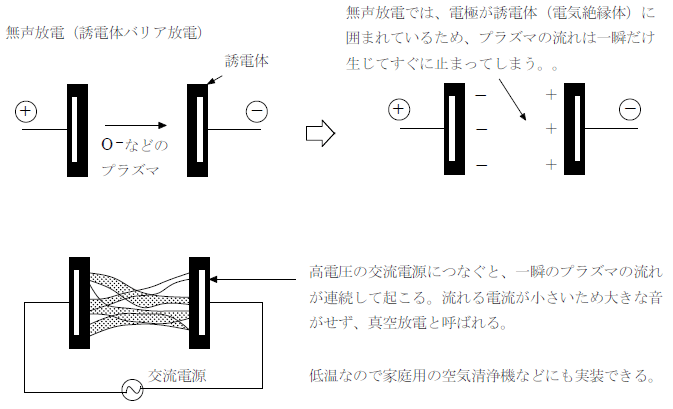
無声放電は放電の一種である。代表的な放電にはアーク放電がある。離れた電極間に一瞬だけ高電圧を加えて空気中に電子の流れを作ると、電子と衝突してできた気体イオン(プラズマ)などが生じて電気抵抗が小さくなる(絶縁破壊)。そのあとは電圧を低くしても大きな電流が流れるようになり、電極間には熱電子やプラズマの流れができる。これは非常に高温となり、溶接などにも用いられる。
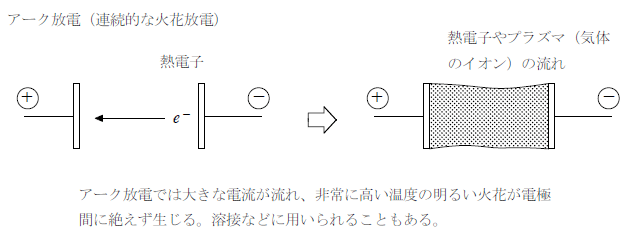
これに対して、電極にガラスなどの誘電体(電気絶縁体)のカバーをかけて高周波数の交流を加えると電流量の小さな火花が連続的に得られる。高電圧であるが電流量が小さいためアーク放電のような高温にならず低コストで安全に放電させることができる。
酸素を含む化合物
1)水
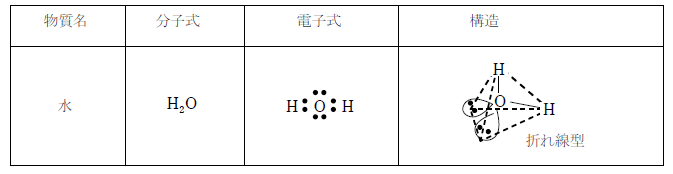
水は結合角が約104.5°の折れ線構造の分子である。非対称型のため極性を持つ。赤色の光を吸収する性質があるため、河川や海の色は青色になる。
酸素と水素からなる化合物である水は特徴的な性質を多く持ち、生命活動の維持にも欠かせない役割を果たしている。
溶媒としての働き
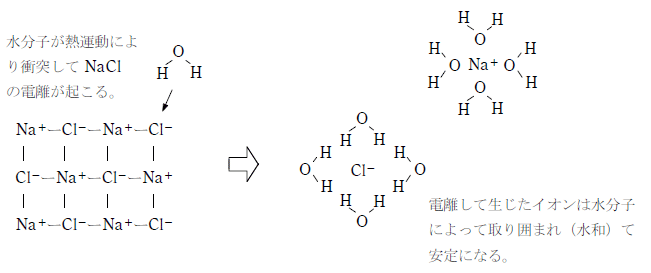
水分子は極性分子のため電解質が電離して生じるイオンや極性のある物質を取り囲んで安定させる作用がある。また、反応性に乏しいため溶質と反応せず、分子量が小さいため熱運動が激しい。このため幅広い物質を溶解することができる溶媒である。
大きな融解熱、蒸発熱
水分子は分子間に水素結合を生じる。水素結合はファンデルワールス力に比べて10倍程度強いため、その切断には大きなエネルギーが必要であり、水は大きな融解熱や蒸発熱を持つ。これは大気の温度を一定に保つ働きをする。
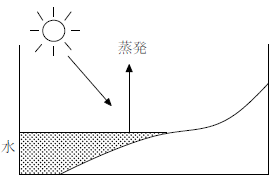
【昼間】
太陽光のエネルギーは水の蒸発熱として使われ、大気の温度上昇が抑制される。
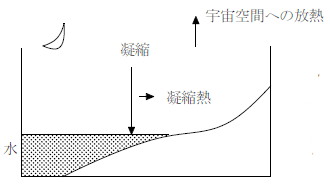
【夜間】
宇宙空間への放熱により気温が下がると、昼間に生じていた水蒸気が凝縮し、凝縮熱が発生する。これにより温度低下が妨げられる。
特異的に高い沸点
分子間にファンデルワールス力より強い水素結合を生じる H2O (分子量18.0)は、特異的に高い沸点を持つ。同族の水素化合物である H2S (分子量34.1)に比べて分子量が半分程度であるにも関わらず、下図に示すように沸点がかなり高い。
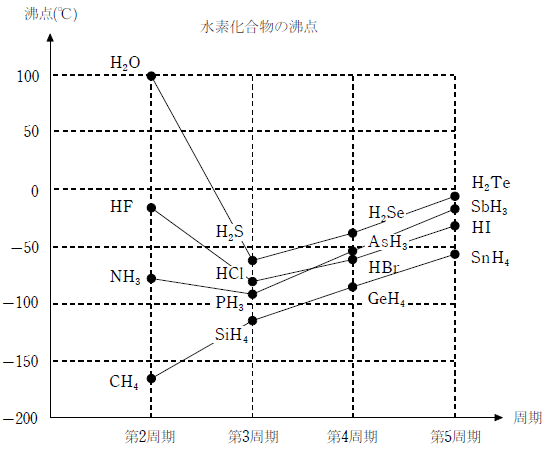
| 分子式 分子量、沸点 | 第2周期 | 第3周期 | 第4周期 | 第5周期 |
|---|---|---|---|---|
| 第17族 | HF 20.0、-19.5℃ |
HCl 36.5、-85.0℃ |
HBr 80.9、-66.4℃ |
HI 127.9、-35.4℃ |
| 第16族 | H2O 18.0、100.0℃ |
H2S 34.1、-60.7℃ |
H2Se 81.0、-41.3℃ |
H2Te 129.6、-2.0℃ |
| 第15族 | NH3 17.0、-77.7℃ |
PH3 34.0、-87.8℃ |
AsH3 77.9、-62.5℃ |
SbH3 124.8、-17.0℃ |
| 第14族 | CH4 16.0、-161.6℃ |
SiH4 32.1、-112℃ |
GeH4 76.6、-88.0℃ |
SnH4 122.7、-52.0℃ |
また、同様に水素結合を作り、同程度の分子量を持つHF(分子量20.0)より沸点が高いのは、分子間に生じる水素結合が、HF が 1 本であるのに対し、H2O が2本だからである。
あるフッ化水素分子に着目すると、隣り合う2分子のフッ化水素分子と水素結合を作っているが、1つの水素結合は結び付いている2分子のどちらにも属しているため、このフッ化水素分子に属する水素結合の本数は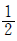 本である。したがって、1分子のフッ化水素が作る水素結合は、
本である。したがって、1分子のフッ化水素が作る水素結合は、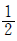 ×2=1本
×2=1本
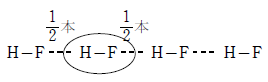
一方、水分子は隣り合う4分子の水分子と水素結合を作るため、1分子の水に属する水素結合の本数は、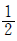 ×4=2本
×4=2本
液体より密度の小さな固体
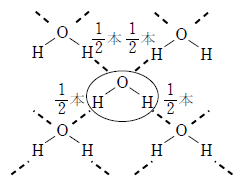
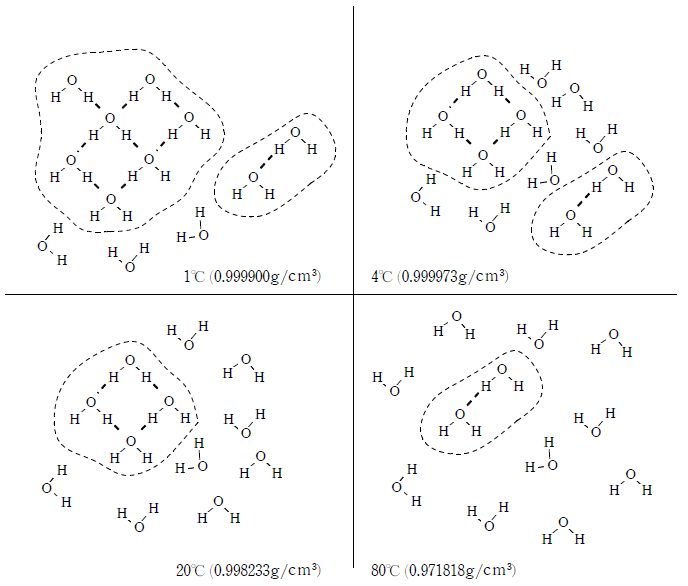
固体の水(氷)は、分子間に水素結合が生じている。水素結合は共有結合に近い性質を持っているので結合の方向が決まっており、そのため、下図左のように分子間の隙間の大きな構造となる。
一方、液体の水は下図右のように比較的自由に動き回るため固体よりも隙間が小さくなり密度が大きくなる。そのため、氷は液体の水に入れると浮くのである。
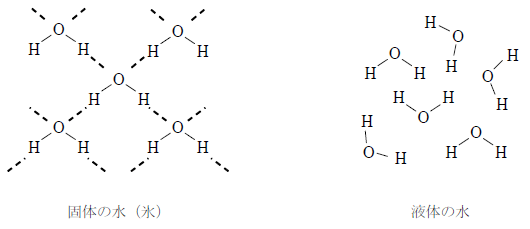
液体の水も、構造の全体を見ると一部が水素結合で結びついた小さな結晶のようになっている。この構造をクラスター構造といい、クラスター構造は絶えず破壊と生成を繰り返している。
クラスター構造の割合は温度が低くなるほど多くなり、密度を増大させる。一方、温度が低くなるほど水分子の熱運動は緩やかになり、分子間距離が小さくなるため密度が減少する。
この相反する2つの効果の兼ね合いで、水は4℃で密度が最大となる。
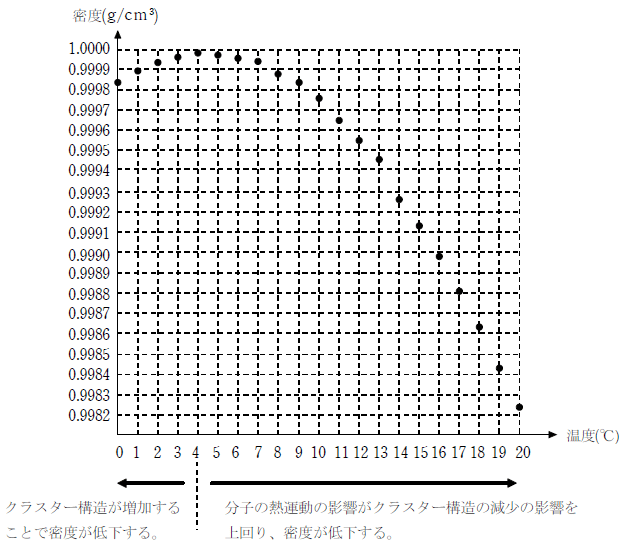
下図がそのイメージである。温度が上がるほどクラスター構造が減少するが、熱運動が激しくなることで分子間の距離が大きくなり、密度が低下する。
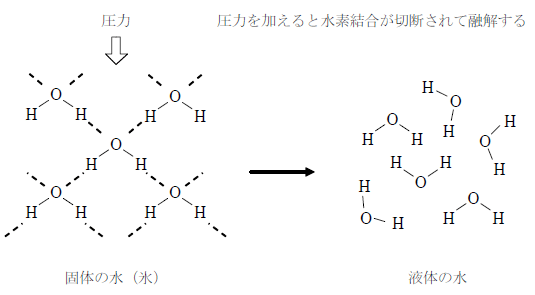
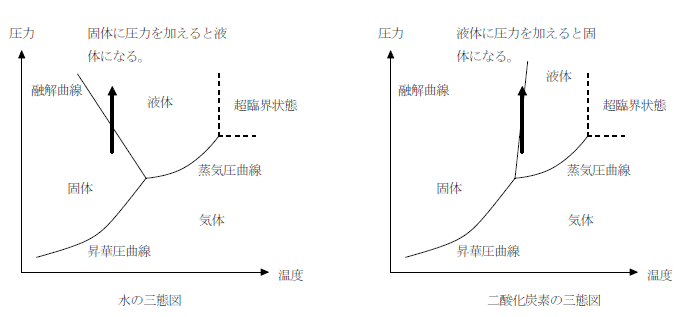
固体に圧力を加えると液体になる性質
固体の水は、水素結合により隙間の多い構造をしている。ここに圧力を加えると、結合が切断されて液体になる。これは水に特有の性質で、他の物質は圧力を加えると固体になる。
このため、水の融解曲線は右下がりになっている。
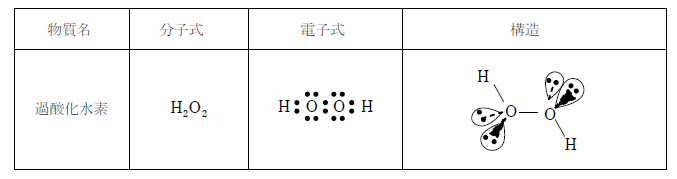
2)過酸化水素
酸化剤としても還元剤としても働く物質で、殺菌漂白作用があり、消毒液、医療の漂白、食品添加物として食品の漂白、半導体の洗浄、汚水処理など多岐にわたって利用されている。酸素の代わりにロケットの燃料(酸化剤)として用いられていた時期もある。
酸化力が強いため、高濃度の水溶液を可燃物に接触させると発火することがある。
不安定な物質で分解して水と酸素になるため環境負荷が小さいことも利用範囲が広い理由の一つである。
【酸化剤としての反応】H2O2 + 2H+ → 2H2O
【還元剤としての反応】H2O2 + 2e- → 2OH-





















































