理論化学
無機化学
第8回 二族元素
二族元素 (Be、Mg、Ca、Sr、Ba、Ra)
二族典型元素とアルカリ土類金属元素
二族元素はいずれも価電子を2個もち、陽イオンになりやすい元素です。いずれも銀白色の軽金属(Raのみ軽金属ではない)で、同周期のアルカリ金属よりも密度はやや大きく、融点も高い。
また、単体の反応性はアルカリ金属に次いで活発です。
二族元素は二族典型元素(Be、Mg)とアルカリ土類金属元素(Ca、Sr、Ba、Ra)の2つのグループに分類され、それぞれ特有の性質を示します。
【二族典型元素】
 |  |
| ベリリウム 融点:1278℃ 密度:1.85g/cm3 原子量:9.0 炎色反応:なし |
マグネシウム 融点:649℃ 密度:1.74g/cm3 原子量:24.3 炎色反応:なし |
【アルカリ土類金属元素】
 |  |  |  |
| カルシウム 融点:839℃ 密度:1.55g/cm3 原子量:40.1 炎色反応:橙色 |
ストロンチウム 融点:769℃ 密度:2.63g/cm3 原子量:87.6 炎色反応:赤色 |
バリウム 融点:725℃ 密度:3.6g/cm3 原子量:137 炎色反応:緑色 |
ラジウム 融点:776℃ 密度:5.6/cm3 原子量:226 炎色反応:洋紅色 |
二族典型元素とアルカリ土類金属元素の性質の違い
二族典型元素とアルカリ土類金属元素はいくつかの性質の違いを持ちます。
まず、二族典型元素は炎色反応を示しませんが、アルカリ土類金属元素は炎色反応を示します。
次に、水との反応、水酸化物の水溶性、硫酸化合物の水溶性が異なります。
炭酸イオンは沈殿を作る力が強いため、二族典型元素もアルカリ土類金属元素も沈殿を作ります。
| 二族典型元素 | アルカリ土類金属元素 | |
|---|---|---|
| 水との反応 | Be:高温の水蒸気と反応してH2発生 Mg:熱水と反応してH2発生 | 冷水とも反応してH2を発生 |
| 水酸化物 | 水に不溶の沈殿 | 水によく溶けて強塩基性を示す |
| 硫酸化合物 | 水によく溶ける | 水に不溶の沈殿 |
| 炭酸化合物 | 水に不溶の沈殿 | 水に不溶の沈殿 |
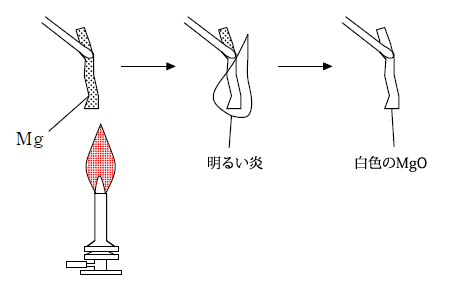
マグネシウム
マグネシウムは銀白色の金属で、炎色反応を示しません。一方、空気中で点火すると明るい炎を上げて燃え、白色の酸化マグネシウム(MgO)となります。酸化マグネシウムは日本では下剤として用いられます。
また、冷水とは反応しませんが、熱水と反応して水素を発生ます。
マグネシウムイオン(Mg2+)を含む水溶液にアルカリを加えると、白色の水酸化マグネシウム(Mg(OH)2)が沈殿します。
カルシウム
カルシウムは銀白色の金属で、橙色の炎色反応を示します。
冷水と反応して水素を発生し、Ca(OH)2となります。C(OH)2は水によく溶ける強塩基性の物質です。
二族元素の中では最も出題される元素ですが、カルシウム単体での出題はあまりなく、カルシウムの化合物が出題されます。
炭酸カルシウム(CaCO3)
炭酸カルシウム(CaCO3)は石灰石や貝殻、卵殻などに含まれ、自然界に多く存在しています。鍾乳洞の主成分もCaCO3です。
CaCO3は弱酸である炭(H2CO3)と強塩基である水酸化カルシウム(Ca(OH)2)の塩なので、塩酸のような強酸を加えると分解してCO2を発生します。
CaCO3+2HCl → CaCl2+CO2+H2O
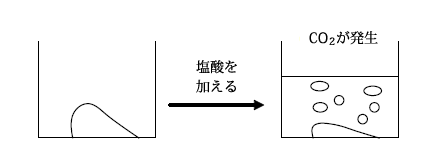
また、加熱によっても分解されて生石灰(CaO)と二酸化炭素(CO2)を生じます。
CaCO3 → CaO+CO2
酸化カルシウム(生石灰:CaO)
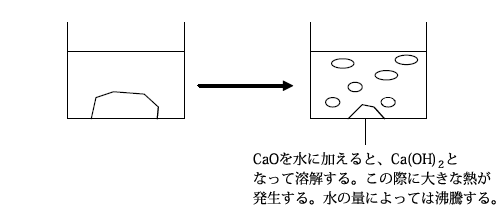
酸化カルシウム(CaO)は生石灰とも呼ばれる物質です。塩基性酸化物で、水と反応すると強塩基の水酸化カルシウム(Ca(OH)2)となります。この際、多量の熱を発生することから、加熱剤として用いられることがあります。
CaO+H2O → Ca(OH)2
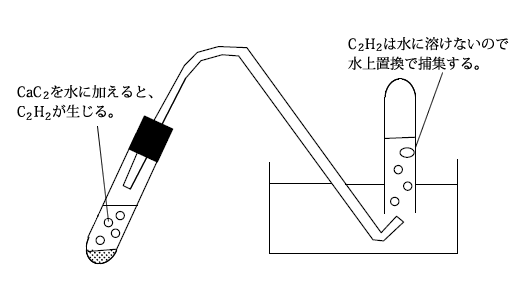
また、酸化カルシウムとコークスを混合して電気炉で強熱すると、炭化カルシウム(カルシウムカーバイド:CaC2)が得られます。
CaO+3C → CaC2+CO
このカルシウムカーバイドに水を加えると、アセチレン(C2H2)が発生します。
CaC2+2H2O → Ca(OH)2+C2H2
水酸化カルシウム(消石灰:Ca(OH)2)
水酸化カルシウム(Ca(OH)2)は消石灰とも呼ばれ、単体のカルシウム、または生石灰に水を加えることによって得られる強塩基です。消石灰の飽和水溶液を石灰水といいます。
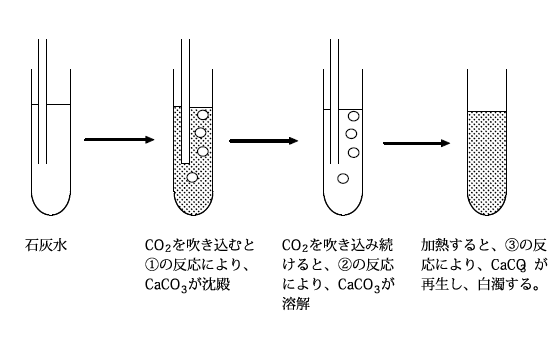
水酸化カルシウムと二酸化炭素の塩は水に不溶なCaCO3なので、石灰水に二酸化炭素を通じると、白色沈殿が生じて溶液が白濁します。この反応は二酸化炭素の検出に用いられます。
しかし、二酸化炭素を過剰に加えると、水に可溶な炭酸水素カルシウムとなり、白濁が消えます。
① Ca(OH)2+CO2 → CaCO3+H2O
② CaCO3+CO2+H2O → Ca(HCO3)2
③ Ca(HCO3)2+H2O → CaCO3+CO2
鍾乳洞ができるメカニズム
鍾乳洞の石柱ができるメカニズムは、石灰石にCO2を吹き込んだ時に起こる反応で説明できます。
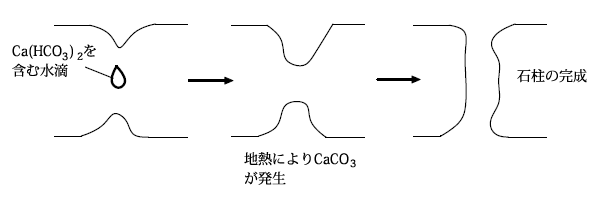
CaCO3が雨水に含まれるCO2と反応してCa(HCO3)となり、溶けだして水滴に混じり地面に落ちる。地面では地熱により、Ca(HCO3)2が分解してCaCO3が再生し、この繰り返しによって天井と地面をつなぐ石柱が生じます。
漆喰(しっくい)
海藻や糸くず、麻などを練ったのりに水酸化カルシウムと水を加えたものを漆喰といいます。漆喰は、空気中の二酸化炭素を吸収して固化する性質があり、古来より日本家屋の壁材として用いられています。
Ca(OH)2+CO2 → CaCO3+H2O
さらし粉
水酸化カルシウムに低温で塩素を吸収させると、さらし粉が生成します。
Ca(OH)2+Cl2 → CaCl(ClO)・H2O
さらし粉は水中で次亜塩素酸イオンを生じるため、強い酸化、殺菌、漂白作用を示します。
硫酸カルシウム
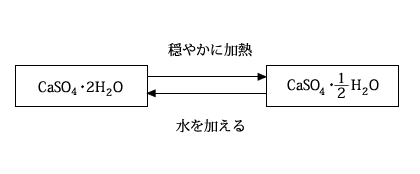
硫酸カルシウム(CaSO4)は水に溶けにくい白色の固体で、硫酸カルシウム二水和物(CaSO4・2H2O)として産出します。この二水和物はセッコウと呼ばれ、骨折した時のギプスや塑像などの材料に利用されます。
セッコウを穏やかに加熱すると、水和水が一部失われて硫酸カルシウム半水和物(CaSO4・1/2H2O)の粉末が生じます。これは焼きセッコウと呼ばれ、水を加えてしばらく放置するとセッコウに戻ります。
カルシウム関連物質
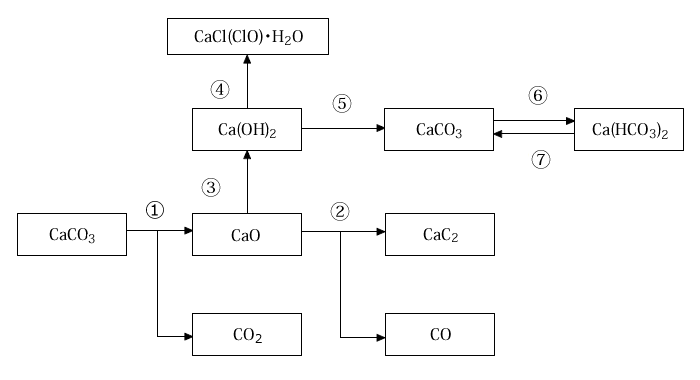
- ① 加熱により分解
- : CaCO3 → CaO+CO2
- ② コークスを加えて強熱
- : CaO+3C → CaC2+CO
- ③ H2Oを加える
- : CaO+H2O → Ca(OH)2
- ④ 冷却しながらCl2を加える
- : Ca(OH)2+Cl2 → CaCl(ClO)・H2O
- ⑤ CO2を加える
- : Ca(OH)2+CO2 → CaCO3+H2O
- ⑥ CO2をさらに加える
- : CaCO3+CO2+H2O → Ca(HCO3)2
- ⑦ 加熱する
- : Ca(HCO3)2 → CaCO3+CO2+H2O