理論化学
化学講座 第5回:電子親和力・電気陰性度
今回は前回に引き続いて、最外殻電子をやり取りする際に生じるエネルギーと電子を引き付ける力の大きさの関係についてお話しします。前回は、電子を奪い取るのに必要なエネルギーの関係について説明しましたが、今回は電子を受け取った時に生じるエネルギーについて説明します。
(2) 電子親和力
電子親和力は、最外殻に電子を1つ取り込んで、原子が1価の陰イオンになるときに生じるエネルギーです。原子は、放出したエネルギーの分だけ安定になりますから、電子親和力が大きければ大きいほど陰イオンになりやすい原子です。次のような感じでイメージしてください。
隕石が星に衝突すると、熱や光とか爆風とかが発生しますよね。これがエネルギーです。隕石を電子、星を原子に置き換えてみましょう。電子が原子に引き付けられて、電子が最外殻電子に飛び込んだときにも同じようにエネルギーが発生するわけです。これが電子親和力です。
衝突のときに発生するエネルギーは星が隕石を引き付ける力が強いほど大きくなりますね。これは電子と原子でも同じです。原子の外部力電子を引き付ける力が強いほど大きなエネルギー、電子親和力が発生します。
逆に言えば、電子親和力が大きな元素ほど原子が強く電子を引き付けており、陰イオンになりやすいと言えます。
そうすると、ナトリウムの電子親和力は相当小さいはずです。何せ電子を捨てたいくらいですからそれほど強く電子を引き付けないはずです。
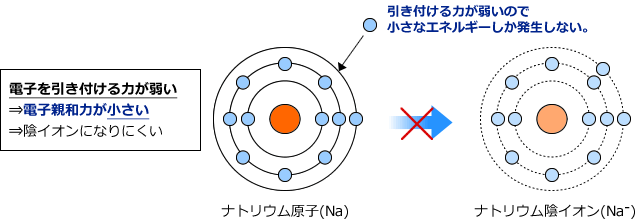
一方、塩素のように強く電子を引き付けている元素の電子親和力はとても大きくなります。
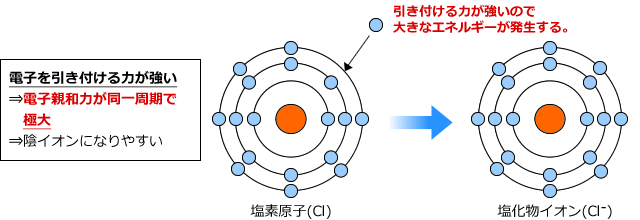
以上のように、電子親和力も第一イオン化エネルギーと同様に、陰イオンになりやすい原子ほど電子親和力は大きく、陽イオンになりやすい原子ほど小さくなります。ですので、周期表の右の方にある元素ほどは大きく、左にあるものほど小さくなる傾向があります。
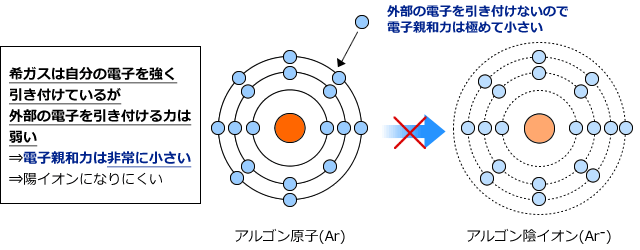
さて、では希ガスはどうでしょうか。希ガスは原子の状態で非常に安定ですから、自分の持っている電子以外を引き付ける力はほとんどありません。ですから、希ガスの電子親和力はほぼ0です。
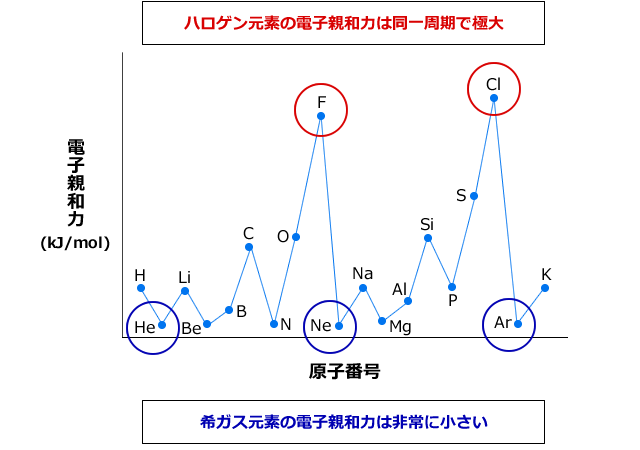
次は、第一イオン化エネルギーのときと同じように、横軸に原子番号、縦軸に電子親和力を取ってグラフを描いてみましょう。すると下図のようになるのですが、第一イオン化エネルギーよりずいぶん凹凸が多いグラフになります。
このグラフで覚えておいてほしいのは、同一周期内で比較するとハロゲン元素の電子親和力が極大になり、希ガスは電子親和力が非常に小さくなる事です。これは結構問われます。大雑把に第一イオン化エネルギーと同じような傾向、という風に覚えていると足をすくわれます。この希ガスについての第一イオン化エネルギーと電子親和力の大きさの違いは覚えておきましょう。
今回はもう1つ、電気陰性度についても説明します。
電気陰性度はイオン化エネルギーや電子親和力と異なりエネルギーではなく、共有電子対を引き付ける力の大きさの尺度です。
(3) 電気陰性度について
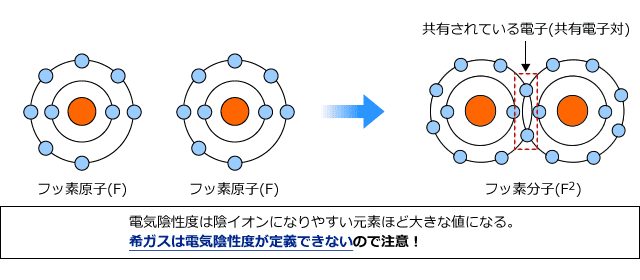
2つの原子が不対電子を出し合って共有電子対をつくり、これを共有する事によってその2つの原子が結合することを共有結合と言います。(詳しくは第6回の章で解説します。)
このとき、原子はそれぞれ共有している電子対を引き付けていますが、この引き付ける力の大きさの尺度を電気陰性度といいます。この大きさが大きければ大きいほど電子を引き付ける力が強いと考えてください。
昔は、マリケンが定義した、マリケンの値を用いていました。マリケンの値とは、イオン化エネルギーと電子親和力の平均値を電気陰性度と定義するものです。電子を引き付ける力の大きさとしては分かりやすい値ではありますが、残念ながら正確ではありませんでした。そこで、ポーリングという人が、マリケンの値の不正確さを修正したポーリングの値を作りました。高校で習う電気陰性度はこのポーリングの値です。
電気陰性度は電子を引き付ける力の大きさですから、イオン化エネルギーや電子親和力と同じように、周期表の右上にいくほど大きく、左下に行くほど小さくなる傾向があります。
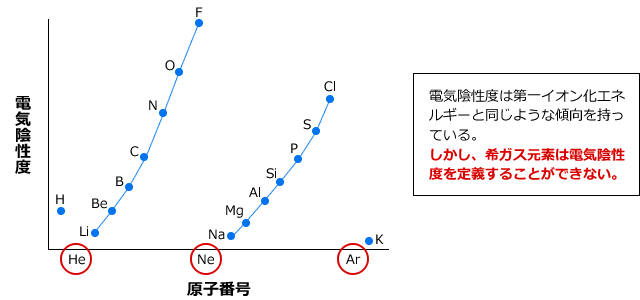
しかし、希ガスは共有結合をしないですから、共有電子対を引き付ける力の大きさである電気陰性度を決める事はできません。したがって、希ガスの電気陰性は定義できません。0とか、すごく小さいというものではないです。定義できないわけですから、グラフを描くと希ガスの所は数値がなくなります。
実際に横軸に原子番号、縦軸に電気陰性度を取ったグラフを描いてみます。
すると、下図のように、同一周期では族番号が大きいほど大きく、同一族では周期が大きいほど小さくなる傾向があることが分かります。傾向としては第一イオン化エネルギーと同じですが、希ガスで極大とならず、値が定義できないことに注意してください。
周期表の上で見てみると、電気陰性度は右上ほど大きく、左下ほど小さくなります。
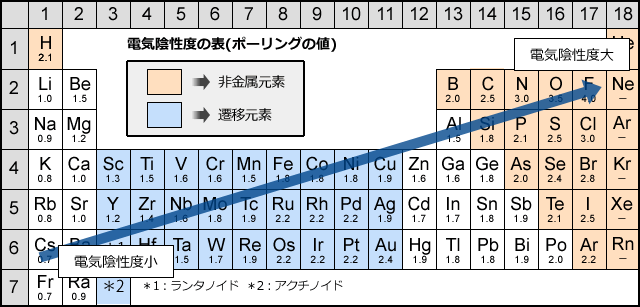
第1族はHだけ電気陰性度が飛びぬけて大きくなっています。これは、Hは最外殻に電子を1つしか持たず、これを失って水素陽イオンになると単なる陽子になってしまい、不安定になるためです。
そして、金属は電気陰性度が小さく、非金属は電気陰性度が大きいのが分かりますね。これは結合を考える上で大事な事ですから、覚えておいてください。
さて、今回はこれで最後ですが、最後にもう一度第一イオン化エネルギー、電子親和力、電気陰性度について整理しておきましょう。
| 第一イオン化エネルギー | 原子の最外殻から電子を一つ奪い取って一価の陽イオンにするのに必要なエネルギー 同一周期では希ガスで極大 希ガスの第一イオン化エネルギーは極めて大きい |
|---|---|
| 電子親和力 | 原子の最外殻に電子を一つ加えて、一価の陰イオンにするのに必要なエネルギー 同一周期ではハロゲンで極大 希ガスの電子親和力は極めて小さい |
| 電気陰性度 | 共有結合のときに、共有電子対を引き付ける力の大きさ 同一周期ではハロゲンで極大 希ガスの電気陰性度は定義できない |
今日はこれでおしまいです。周期表の見方が分かると、化学が分かりやすくなってきます。頑張って勉強してください。それでは、また。