理論化学
化学講座 第8回:水素結合と水の性質
今回は、少し変わった水の性質についてお話しします。
その変わった性質というのは、(1)固体の密度が液体の密度より小さい(氷は水に浮く)、(2)固体に圧力を加えると融解して水になる、(3)分子量のわりに高い沸点、(4)大きな蒸発熱と凝縮熱、の4つです。
どう変わっているのか?それはなぜなのか1つずつ説明していきます。
(1)固体の密度が液体の密度より小さい
コップに氷を入れて水を入れると、氷は全体の2割くらいを水面上に出して浮かびますね。皆さんは子供のころからそれを見慣れているから不思議に思わないかもしれませんが、実はこれは水に特有の不思議な現象なのです。
固体というのは、原子や分子が化学結合によって整然と並んだ状態です。筆箱に鉛筆やシャープペンシルを入れるとき、ぐちゃぐちゃに入れるよりも整然と並べて入れる方がたくさん入りますよね。それと同じで、普通は同じスペースに固体の方が液体よりもたくさんの分子が入って、密度が大きくなります。
だから、エタノールの固体をエタノールの液体の中に入れると沈んでしまいますし、水以外の物質は同様に個体の方が液体より密度が大きくなります。

水 :固体の密度<液体の密度
水以外:固体の密度>液体の密度
では、なぜ氷を液体の水に入れると、氷の方が浮いてしまうのでしょうか。
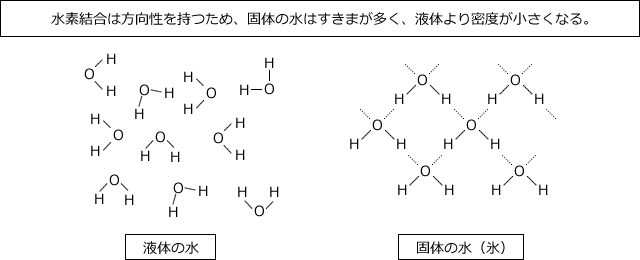
それは、氷では水分子が水素結合で結びついて、隙間の多い構造になっているからです。
前回説明したように、水素結合には方向性があり、水分子は折れ線構造をしています。ですから固体になると右下の図のように隙間の多い構造になってしまいます。一方、液体のときには水分子は自由に動くことができるため、個体より分子間の隙間が少なくなり密度が大きくなるのです。
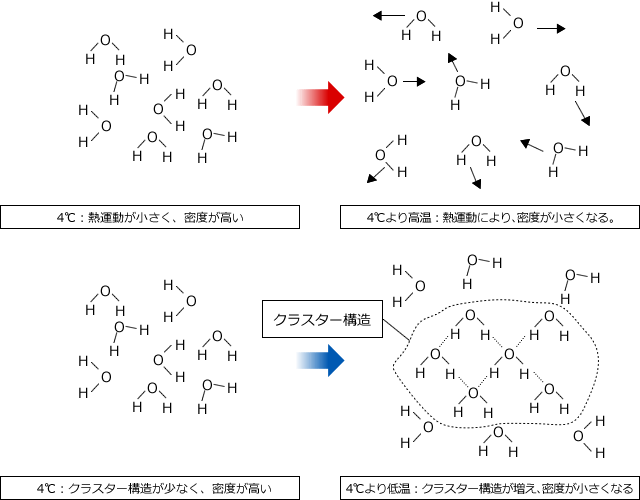
水の密度は温度により変わり、4℃のときに最大となります。なぜなら水の密度は分子の形状と結合のようすと、熱運動の激しさによって決まるためです。
温度が下がると水素結合をする部分が増え、局部的な水分子の塊が生じます(クラスター構造)そのため、密度は減少します。逆に温度が高くなると、熱運動が激しくなるため分子が占める空間が大きくなり、密度は減少します。この2つの効果が最小になるのが4℃のときで、このとき密度が最大になるのです。
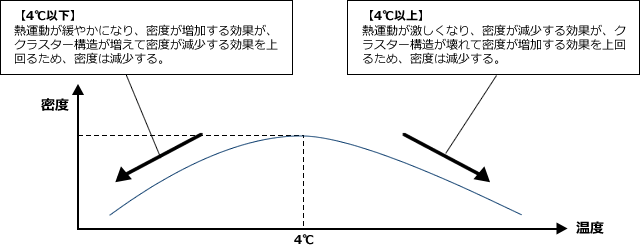
(2)固体に圧力を加えると融解して水になる
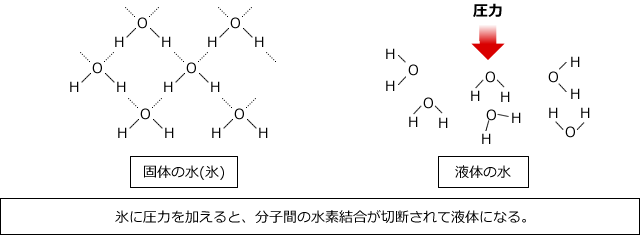
氷は圧力を加えると融解して水になります。これも普通の物質とは逆で、普通の物質は液体に圧力をかけると分子間の距離が短くなって結合し、固体になります。
なぜ氷に圧力をかけると融解するのかというと、氷は水分子が水素結合で結びついた隙間の多い構造になっており、強い圧力を加えるとぐじゃっとつぶれてしまい、水素結合が切断されてしまうからです。
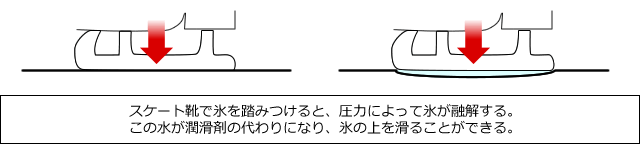
この性質を利用したのがアイススケートです。
スケートの靴には金属のブレードがついていて、これを履いて氷の上に立つと、ブレードの下に大きな圧力がかかります。そうすると、圧力のかかった部分の氷が融解して水になり、これが潤滑剤となって滑ることができるのです。ただし、融解する水の量は多くないため、スケートが通り過ぎると融解して生じた水は、周囲の氷によって冷却されて凝固し、再び氷に戻ります。
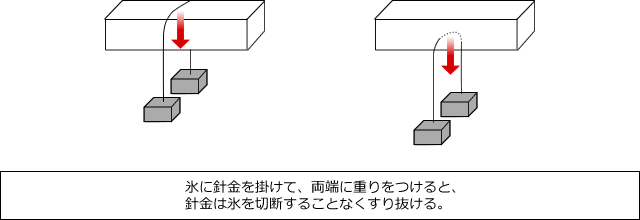
また、大きな氷の塊に針金をかけてその両端に重りをつけると、針金の下に圧力がかかるため、氷が融解して針金は氷に食い込んでいきます。一方で、針金の上側には圧力がかかっていませんから、生じた水は周りの氷によって冷却されて再び氷に戻ります。
しばらく放置すると、針金は氷を通り抜けて下に抜けますが、氷は切断されずに残ります。
横軸に温度、縦軸に圧力を取り、物質の状態を図示したものを三態図と言います。水は、圧力を加えると融解するため、この三態図の固体と液体の境界の線(融解曲線)が左に傾きます。
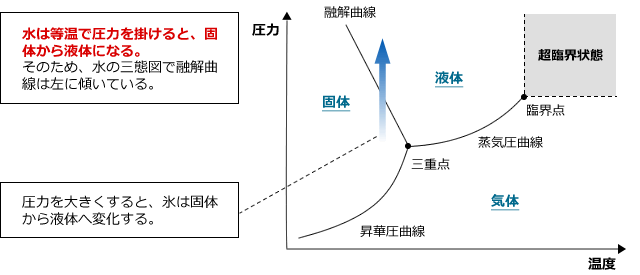
三態図には3本の線が走っています。1本は先ほど紹介した融解曲線、もう2本は固体と気体の間の線を昇華圧曲線、気体と液体の間の線を蒸気圧曲線です。
ここで、昇華圧曲線と聞いて、えっと思った人も多いですよね。そうです。実は氷は一定以下の温度で圧力を減少させると、ヨウ素やドライアイスのように昇華するのです。
この性質はフリーズドライとしてインスタントラーメンなどの食品や粉薬の製造などに用いられています。水を含んだ薬品や食品を冷却して凍結させたうえ減圧すると、氷が昇華して加熱することなく乾燥することができるのです。
昔の薬は薬効成分のある薬草などを煎じた液体の薬が主流でしたが、良薬口に苦し、と言うように、この液体の薬は飲むのが大変で、苦痛に感じるほどだったそうです。しかし、乾燥させて飲みやすくしようとして加熱すると、熱によって薬効成分が破壊されてしまい、薬としての効果がなくなってしまいます。そのため、液体で飲むしかなかったのです。
ところが、このフリーズドライという製法が現れてから、薬効成分を破壊することなく乾燥させることができるようになったため、液体の薬は急速に消えていき、飲みやすい粉薬や錠剤が主流になったのです。
また、融解曲線と蒸気圧曲線と昇華圧曲線の3本が交わる点を三重点といい、この点では液体と固体と気体が共存することができる点です。
最後にもう1つ。温度、圧力を一定以上の大きさにすると、超臨界状態という液体でも固体でも気体でもない状態になります。超臨界状態では圧力が高いため密度は液体と同じですが、温度が高く熱運動が激しいので、分子間に結合が生じていません。つまり、超臨界状態の水は液体と気体の両方の性質をもっているのです。
この超臨界状態の水は物質を溶解させる力が強いため、コーヒー豆からコーヒーの成分を抽出する時などに用いられています。
(3)分子量のわりに高い沸点
水素結合は比較的強い結合で、ファンデルワールス力による結合の10倍程度の強さがあります。(共有結合はファンデルワールス力による結合の100倍程度)ですから、水素結合をする物質は水素結合をしない同程度の分子量の物質より沸点が高くなります。
実際に、14族~17族の元素の水素化物の沸点を並べてグラフを作ると、下図のように水素結合を作るHF、H2O、NH3,の沸点が他の物質に比べて著しく大きくなります。
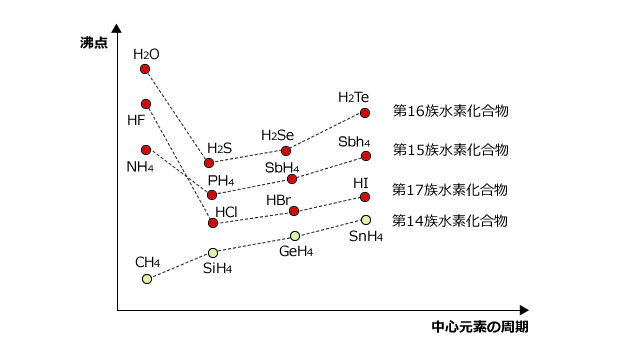
この中で、14族水素化合物の沸点は、CH4が水素結合をしないため左下がりの曲線になります。
なぜCH4がなぜ水素結合をしないのかというと、C-Hの結合は、Cの電気陰性度がそれほど大きくないため電荷の偏りがそれほど大きくないためと、Cは価電子全て用いて4つの共有結合を作っていて、水素結合に必要な非共有電子対が存在しないためです。
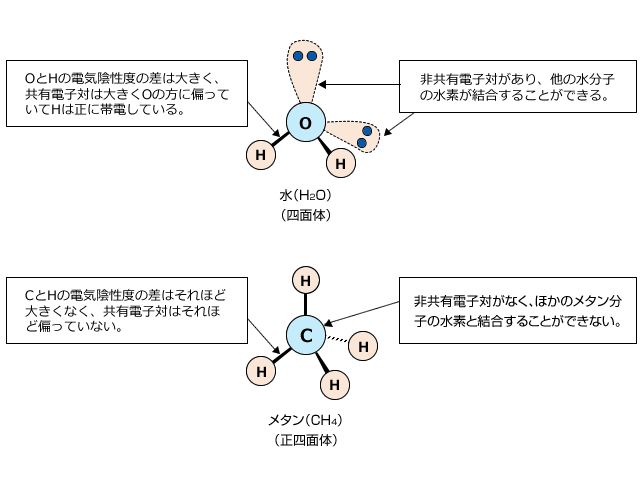
ところで、このグラフで気になるところはありませんか?H2OとHFの沸点がなぜ逆なのだろうか、と思った人はきちんと勉強していますね。H2Oの分子量は18、HFの分子量は19ですから、 共に水素結合をしているんだし、H2Oの方が分子量が小さい分だけ沸点が低くなりそうです。
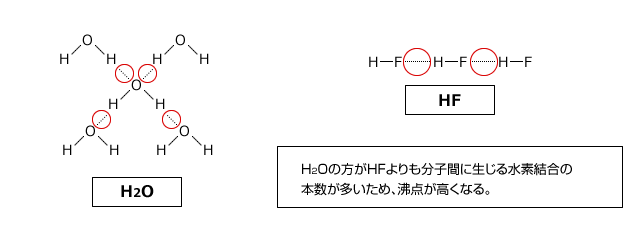
では、なぜHFの方が沸点が低くなっているのでしょう。これは、H2Oは1分子に2個の非共有電子対と2個の水素があるため4か所で水素結合をするのに対し、HFは水素が1つしかないため、2カ所でしか水素結合を作れないからです。
(4)大きな蒸発熱と凝縮熱
水素結合は比較的強い結合なので水は分子量の割に沸点が高く、蒸発する際に周囲から多くの熱をうばい、凝縮する際には周囲へ多くの熱を放出します。
この性質が、地球上の温度変化を抑制してくれるため、我々は地球上に生活できるのです。
砂漠のように水の無い環境では、日中に50℃を超える温度になったかと思うと、夜間は氷点下になったりします。一方で、水に囲まれた日本ではこんな極端な温度変化はありませんね。また、水のない月では最低気温が-233℃、最高気温が123℃と、地球の-111℃、60℃にくらべて温度の変化が大きくなります。
これは、次のようなメカニズムで水が温度をコントロールしてくれているためです。
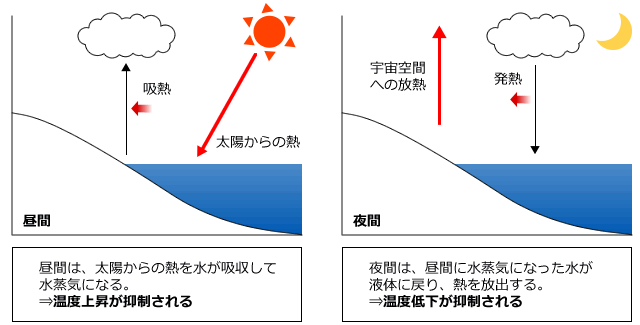
昼間は、太陽から地上に降り注ぐ熱を水が吸収して、水蒸気になります。このように水から水蒸気に変化するときに吸収される熱量の事を蒸発熱と言います。
水は蒸発熱が非常に大きいため、たくさんの熱量を吸収することができます。そのため、どんなに太陽が照っていても温度がそれほど上がらないのです。これを利用したのが打ち水で、水を撒くと、水が熱を吸収して水蒸気になるため、温度が下がるのです。
一方、夜間になると、宇宙空間への放熱が起こり(宇宙空間への放熱は昼間も起こっていますが、昼間は太陽から降り注ぐ熱の方が放熱量より多い)温度が下がります。そうすると、昼間、熱量を吸収して水蒸気になっていた水が、凝縮して水になります。このとき、吸収した熱量と同じ大きさの凝縮熱を放出するため、温度が下がりにくくなるのです。
このようにして生じる水には、霧や露を挙げることができます。霧は昼間の温度が高くて夜の温度が低いと発生しやすいし、露も夏の朝に生じることが多いですよね。
これは、昼間に水蒸気がたくさん発生して、夜や朝方になるとそれが冷却されて水に戻るからです。
今回はこれくらいにしましょう。次回は分子性物質の特徴について説明します。
分子間力
原子の性質は、その原子の最外殻電子数によって決まりましたが、物質の性質は、その物質を構成する分子、あるいは原子、イオン間に生じる結合の強さによって決まります。例えば、融点や沸点は物質の熱運動が結合による束縛に打ち勝つ瞬間の温度なので、融点や沸点は結合が強くなるほど高くなります。
分子とは、共有結合でいくつかの非金属元素の原子が結合してできた「原子のかたまり」であるという事は前回説明しました。
今回は、分子間に働く力と、分子で構成された物質の性質について説明します。
分子間には大きく分けて二種類の引力が働いています。1つはファンデルワールス力といって全ての分子間に働く、共有結合の100分の1位の大きさの非常に弱い力です。もう1つは水素結合といって水素とフッ素、水素と酸素、水素と窒素の結合を持つ分子間にはたらく力で、共有結合の10分の1くらいの大きさの力です。

分子間には、引力が働く。
・ファンデルワールス力 (全ての分子間)
・水素結合 (一定の条件を満たした分子間)
これらをまとめて分子間力という。
ファンデルワールス力
ファンデルワールス力は分子間に働くクーロン力で、電荷の偏りを持たない無極性分子間にも働きます。
電荷がないのにクーロン力がどうやって働くの?と、疑問に思うかもしれませんね。分子の周りには電子が何重にも取り巻いています。この電子はじっとしているのではなくて、決められた電子軌道の中をランダムに動き回っているのです。
動き回っていると、偶然一方に電子が偏ってしまうことがあります。
つまり、瞬間的には分極した極性分子のようになるのです。
そうすると隣の分子の電子も分極した分子からクローン力を受けて偏ります。隣に正電荷が現れたので、思わず引き付けられてしまうわけですね。
そうすると、この2分子の間にはクーロン力が生じてひきつけあいます。すぐに電子が移動して分極はなくなってしまうので、この力は瞬間的なものにすぎませんが、分子で構成される物質の中ではこういう瞬間的な引力がたえず生じているのです。

分子間にはたえず瞬間的なクーロン力による引力が働いている。
その時間平均が分子間に働くファンデルワールス力の正体です。
分子間に働く引力を発見したのは、気体の状態方程式を研究していたファンデルワールスでした。彼は、気体分子の挙動を研究している時に、分子間に引力が働いていることに気がついたのです。
ですから、今でも分子間に働く力を全部まとめてファンデルワールス力と呼ぶことがあります。
ただし、この講義ではファンデルワールス力は分子間の瞬間的な分極(瞬間双極子と言います)により生じる力の事を指すことにします。
さて、このファンデルワールス力ですが、あくまでもクーロン力なので、「電荷が大きく」「距離が近い」ほど強く働きます。ですから、分子が大きいほど強いファンデルワールス力が働きます。
さて、なんで分子が大きいほど強いかわかりますか?
分子が大きいと、電荷の偏りも大きくなります。つまり、瞬間的に生じる電荷が大きくなるのです。 分子の大きさは分子量で考えればいいですから、分子量が大きければ大きいほどファンデルワールス力は強くなります。
例として水素と臭素の沸点を比べてみましょう。水素の沸点が-252.8℃であるのに対し、臭素の沸点は58.8℃です。これは、分子量が水素(分子量2)より大きな臭素(分子量160)の方が分子間に大きなファンデルワールス力が生じるためです。

【分子量が大きい=分子が大きい】ほど、電荷の偏りはダイナミックになり、大きく分極するため分子間に働くクーロン力は大きくなる。
分子量が大きいほど大きなファンデルワールス力が働く。
従って、分子量が大きければ大きいほど沸点・融点が高くなる。
ファンデルワールス力の大きさを決める要素にはもう1つあります。それは分子の形状で、細長い物の方がファンデルワールス力は大きくなります。分子の形状が細長いと、分子同士はより接近することができます。したがって、分子量が同程度であれば、ファンデルワールス力は細長い形の分子ほど強く働きます。
例としてペンタン(直鎖状)2-メチルブタン(枝分かれ構造)、1,2‐ジメチルプロパンを比較してみると、分子量は全て同じですが、沸点はペンタン>2-メチルブタン>1,2-ジメチルプロパンの順になっています。

ちなみに、2-メチルブタンはイソペンタン、1,2-ジメチルプロパンはネオペンタンとも言います。この名前で出てくることもありますから、覚えておきましょう。
分子の極性
さて、異なる種類の原子間に働く共有結合では、電気陰性度の違いに基づく電荷の偏りが生じます。つまり、電気陰性度の大きな原子のほうに共有電子対が引き寄せられ、その原子が負に帯電する一方で、もう一方の原子は正に帯電します。これは前回お話ししましたね。

今回は、分子全体の電荷の偏りを考えてみます。まず、メタンと二酸化炭素を例にとって考えてみましょう。
下図を見ると分かるように、メタンや二酸化炭素では、炭素と水素、炭素と酸素は電気陰性度の大きさが違いますから、1つ1つの結合には電荷の偏りがあります。しかし、分子の形が対称形ですから、分子全体ではその偏りが打ち消しあってしまうのです。ですから、分子全体での電荷の偏り、つまり、分子の極性は無いのです。

ただ、分子の形状が対称形だと電荷の偏りが打ち消されるという説明だけでは今ひとつわかりにくいですよね。そこで、分子全体の電荷の偏りは、電荷の重心の位置を考えると良く分かります。無極性分子では、正電荷の重心と負電荷の重心が一致するため、電荷の偏りがなくなり、極性分子では正電荷の重心と負電荷の重心が一致しないため分子全体に電荷の偏りが生じるのです。
例えば、メタンと二酸化炭素では正電荷の重心と負電荷の重心が一致します。そのため、正電荷と負電荷がお互いに打ち消し合ってしまい、全体は無極性になるのです。
次に、クロロメタンを考えて見ましょう。分子の形状が非対称形をしていますね。ですから、分子内にある結合に生じている電荷の偏りは打ち消されず、分子全体でも電荷の偏りを生じます。つまり、クロロメタンには極性があるのです。

これも電荷の重心の位置で考えてみましょう。上図右側が電荷の重心位置を示したものですが、負電荷がやや上の方(Cl原子に近い方)にあるのに対し、正電荷の重心位置はやや下の方(H原子に近い方)にあって、電荷の重心位置は一致しません。これは、この分子を作っている元素の中で、塩素原子が最も電気陰性度が大きく水素原子が最も電気陰性度が小さいためです。
電気陰性度の大きい塩素が電子を強く引き付けてしまっているんですね。
したがって、クロロメタンではClの方がやや負に帯電し、Hの方がやや正に帯電しているのです
さて、ファンデルワールス力というのは、瞬間的な分極によって生じるクーロン力の時間平均であることはお話しした通りです。それなら、瞬間的でなく、最初から極性を持っている分子間にはより強い力が働くことになりますよね。ですから、極性のある分子は極性のない分子よりも沸点が高くなります。
例えば、無極性分子のフッ素(分子量38)は沸点が-188℃であるのに対し、極性分子の塩化水素(分子量36.5)は沸点が-85.1℃です。
このように、極性分子間には無極性分子間に働く力よりも強い力が働いています。そして、この極性がうんと大きくなると、分子間には極性分子間に働くクーロン力よりもずっと大きな力が働くようになります。これが水素結合です。
水素結合
水素結合ができる条件はH-F、H-O、H-Nの結合があることです。例えばHFやH2OやNH3などですね。
ここからは、水素結合について見ていきましょう。F、O、N、の3つは電気陰性度のトップ3です。それに対して、水素は非金属の中でもかなり電気陰性度が弱い元素です。したがって、これらの分子では、分子内にとても大きな極性が存在します。

例えば、フッ化水素分子では、電子軌道にあった電子はフッ素原子に強く引き付けられてしまい、水素原子の周りには電子がほとんどない状態になってしまいます。

すると、この水素は近くにあるF原子の非共有電子対を一部取り込んで安定化します。つまりH原子が隣のF原子に配位結合的に結合するわけです。これが水素結合の正体です。

ただし、水素結合はあくまで配位結合に似たメカニズムで生じるというだけで、結合の強さはずっと弱く、配位結合(共有結合)の10分の1程度です。でも、無極性分子間に働くファンデルワールス力よりは10倍くらい強い力ですから、水素結合を形成している物質の沸点は、無極性分子が集まってできる沸点よりずっと高くなります。

水分子やアンモニア分子間には上図のように水素結合が生じます。ひょっとしたら気が付いているかもしれませんが、この水素結合が生じる方向は決まっています。分子の形状で説明したように、非共有電子対は原子核の周りに均一に広がっているわけではなく、ある特定の方向に広がっています。水素結合はその広がりの方向にしか生じないのです。
水分子はこの水素結合のおかげで様々な性質を示します。例えば、液体より密度の低い固体等です。これは、水素結合が生じる方向が決まっているため、固体はスカスカで密度が小さくなってしまうからです。
実は、我々人類が地球上で生活できるのは、水分子が水素結合によって生じる性質のおかげなのですが、その話は次回にゆずることにして、今回はこのあたりで終わろうと思います。





















































