理論化学
化学講座 第12回:密度と濃度
濃度や密度の問題は、みんなあまり好きではないですよね。
もう少し言うと、濃度や密度に限らず、割合の取り扱いが苦手な人が多いようです。
これらの値は足したり引いたりすることができないし、その値が出てくるとたいてい単位が変わってしまうからイメージがしにくいのではないかと思います。
でも、化学の問題には濃度や密度が必ずといってよいほど入っているし、どうしても避けては通れない重要なものです。
今回は、濃度や密度のイメージを作りながら、その使い方になれていきましょう。
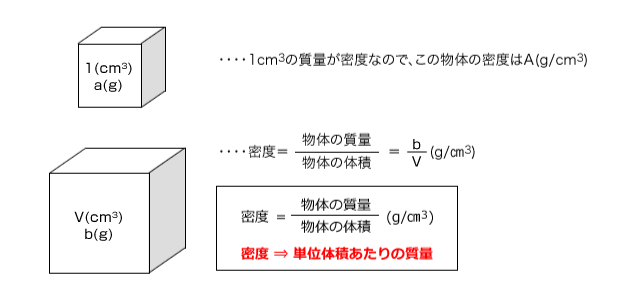
密度
密度とは、単位体積当たりの質量の事です。単位体積とはその問題でつかう体積の単位で1体積の事です。例えばある問題で、体積を(cm3)で表していたら、その問題での単位体積は1(cm3)ということになります。
つまり、ある物体があって、その物体の1(cm3)の質量がa(g)だったとすると、密度はa( g/ cm3)となるわけです。
では、体積V(cm3)、b(g)の物体があったら、その密度は何(g/cm3)となるでしょうか。
ちょっと考えればわかりますよね。この問題では単位体積は1(cm3)です。V(cm3)でb(g)なのですから、1(cm3)の質量は、![]() (g)ですよね。つまり、この物体の密度は
(g)ですよね。つまり、この物体の密度は![]() (g/)cm3なのです。
(g/)cm3なのです。
次に、この物体と同じ物質で構成されているU(cm3)の物体の質量を求めてみましょう。この物体を構成している物質は1(cm3)あたりの質量が![]() (g)ですね。この物質がU(cm3)あつまってできているわけですから、その質量は、
(g)ですね。この物質がU(cm3)あつまってできているわけですから、その質量は、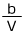 ×U (g)になりますよね。
×U (g)になりますよね。
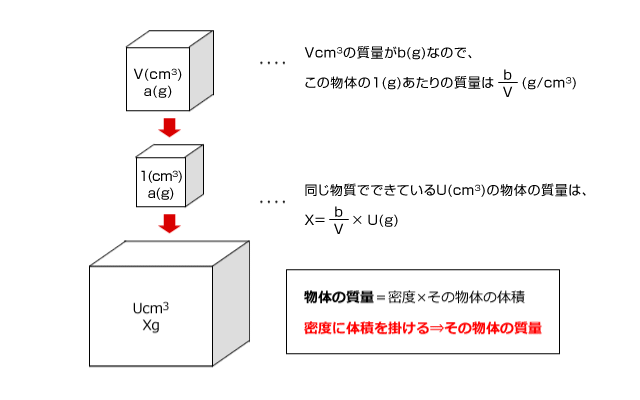
どうですか?密度についてのイメージができましたか?では、次に計算の練習をしてみましょう。
例題
-
100(m3)で2000(kg)の物質の密度は何(g/cm3)か。
1)の物質10(ℓ)の質量はいくらか。
(解説・解答)
単位の取り扱いに注意しましょう。
1(m)=100(cm)ですから、1(m)3=1003(cm)3=106(cm)3です。
また、1(kg)=103(g)ですから、2000(Kg)=2×106(g)です。
したがって、この物質の密度は 2×106(g)÷106(cm)3=2.0(g/cm)3となります。
-
1(ℓ)=1000(cm3)ですから、10(ℓ)=104(g)です。
したがって、この物質10(ℓ)の質量は、2.0×104(g)となります。
ちなみに、化学では密度の単位として、(g/cm3)や(g/ml)がよく用いられます。
濃度(モル濃度、質量モル濃度、質量パーセント濃度)
濃度は、溶液の量と溶質の量の割合を表したもので、溶液の量または溶媒の量と溶質の量を結びつけます。
化学で用いる濃度は、体積モル濃度、質量モル濃度、質量パーセント濃度の3種類です。体積モル濃度は容量モル濃度あるいは単にモル濃度、体積モル濃度は重量モル濃度とも言います。
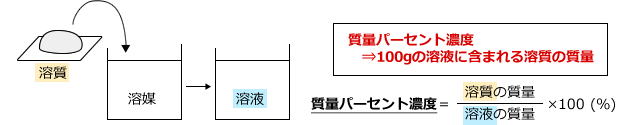
(1) 質量パーセント濃度
質量パーセント濃度は、溶液の質量にたいして溶質の質量がどれくらい含まれているかを表すもので、100(g)の溶液中に含まれる溶質の質量(g)を表します。
20%なら溶液100(g)あたり20(g)の溶質が溶けているということです。
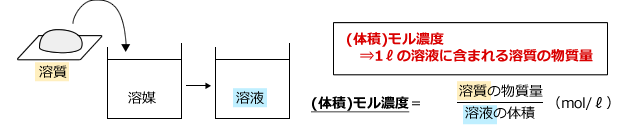
(2) (体積)モル濃度
体積モル濃度は、溶液1ℓに溶質が何mol含まれているかを表すもので、化学では最も良く使う濃度の単位です。
0.1(mol/ℓ)であれば溶液1ℓあたり0.1(mol)の溶質が含まれているというこうとです。
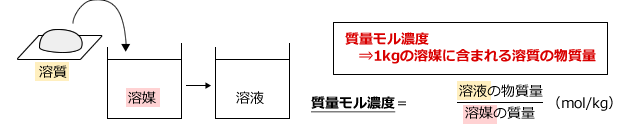
(3) 質量モル濃度
質量モル濃度は、溶媒1㎏に溶質が何mol含まれているかを表すもので、凝固点降下、沸点上昇などを計算するときに用いられる濃度の単位です。
0.1(mol/kg)であれば、溶媒1(kg)あたり0.1(mol)の溶質が含まれているということです。
密度に引き続いて濃度のイメージもできましたか?
それでは、計算練習をしてみましょう。
例題)
0.50(mol/ℓ)のNaOH水溶液500(mℓ)がある。この水溶液中のNaOHの物質量を求めなさい。
0.50(mol/ℓ)のNaOH水溶液の密度を1.0(g/mℓ)とする。この水溶液の質量パーセント濃度を求めなさい。
質量モル濃度が4.00(mol/kg)の水酸化カリウム水溶液60(g)に、水40(g)を加えたら、密度が1.17(g/mℓ)の水溶液になった。モル濃度はいくらか。K=39 、O=16、H=1としてよい。
(解説・解答)
-
0.50(mol/ℓ)というのは、溶液1(ℓ)あたり溶質が0.50(mol)溶けているという意味ですね。
そして、この水溶液の体積は500(mℓ)=
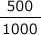 (ℓ)です。
(ℓ)です。よって、この水溶液に溶けている溶質NaOHの物質量は0.50×
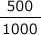 =0.25(mol)です。
=0.25(mol)です。ここで使った
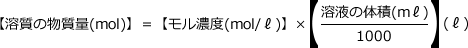
という式は、今後何度も使いますから、覚えておいて下さい。
いわゆる濃度の単位変換の問題です。濃度変換は難しい問題に分類されているようですね。大学生でもできない人を見かけます。ただ、これはコツを知っていれば簡単です。
濃度変換のステップ
1)変換後の濃度の定義式を書く。
2)1)で書いた定義式に出てくる量を求める。
3)2)で求めた値を、定義式に代入して計算する。
※ 溶液の量が分からないときは1(ℓ)で考える。まず、変換後の濃度の定義式を書きます。
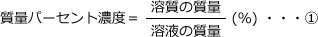
この式を見ると、質量パーセント濃度を求めるためには、溶質の質量と溶液の質量が分かれば良いことがわかります。
与えられた条件から溶質の質量と溶液の質量が求まらないか考えてみますが、どちらもこの溶液の量が分からないと求めようがなさそうです。
そこで、1(ℓ)の溶液を仮定して考えます。濃度は溶液の量によりませんから、100(ℓ)で考えても、1(μℓ)で考えても濃度は同じです。従って計算しやすい量を仮定すればいいわけです。まず、溶質の質量から求めます。モル濃度が0.50(mol/ℓ)ですから、この溶液の中に入っている溶質の物質量は、0.50(mol/ℓ)×1(ℓ)=0.50(mol)ですね。
NaOHの式量は40ですから、溶質の質量は0.50(mol)×40=20(g)となります。
つぎに、溶液の質量を求めます。1.0(g/mℓ)の溶液が1(ℓ=1000mℓ)ありますから、溶液の質量は、1.0×1000=1000(g)となります。
最後に、これらの値を最初に書いた定義式に代入すれば、質量パーセント濃度が求まります。
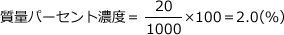
モル濃度を求めるのに必要なのは、溶液の体積と溶質の物質量でしたね。溶質の物質量は濃度が分かっていますから簡単に求められそうですが、問題は溶液の体積です。
まず、溶質の物質量から求めましょう。希釈する前後で溶質の物質量は変わりませんから、希釈する前の条件で考えます。
溶液に含まれるKOHの物質量をχ(mol)と置きます。この質量は56χ(g)です。
すると、溶媒の質量は60-56χ(g)=(60-56χ)×10-3(kg)
質量モル濃度の式にこれらの値を代入します。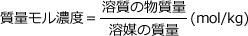
ここへ代入すると
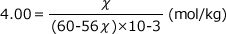
これを解くと、
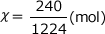
次に、溶液の体積は、40+60=100(g)ですから。
溶液の密度は1.17(g/mℓ)なので溶質の体積は
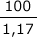 (mℓ)となります。
(mℓ)となります。よって、モル濃度は
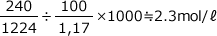
溶液の調製
決まった濃度の溶液をつくることを調製といいます。水溶液の調製の方法を、0.10(mol/ℓ)のNaCl水溶液100(mℓ)を正確に作る方法を例として説明します。
0.10(mol/ℓ)の水溶液ですから、100(mℓ)の水溶液中に溶質のNaClが0.010(mol)溶けていればいいことになります。
そこで、0.010(mol)のNaCl(式量58.5)を正確に量りとって、水に溶かして100(mℓ)の水溶液にします。
NaClの式量は58.5ですから、必要なNaClは0.010×58.5=0.585(g)ですね。
このとき、正確に水溶液の体積を100(mℓ)にするためにメスフラスコという器具を用います。
メスフラスコは下図のような器具で、細長くなった首のところに標線と呼ばれる線が入っており、この線まで水を入れると正確な体積の溶液を作ることができます。

小さなビーカーで液体のNaClを純水に溶かし、ろうとを使ってメスフラスコに入れます。
NaCl水溶液をメスフラスコに入れた後、ビーカーを純水で洗い、洗った液も一緒にメスフラスコに入れます。これは、ビーカーの壁面などに残った水溶液に含まれているNaClを回収するためです。メスフラスコに純水を入れて水面が標線の所に来るようにすれば、100(mℓ)の0.10(mol/ℓ)NaCl水溶液の完成です。
これを絵にまとめると次のようになります。
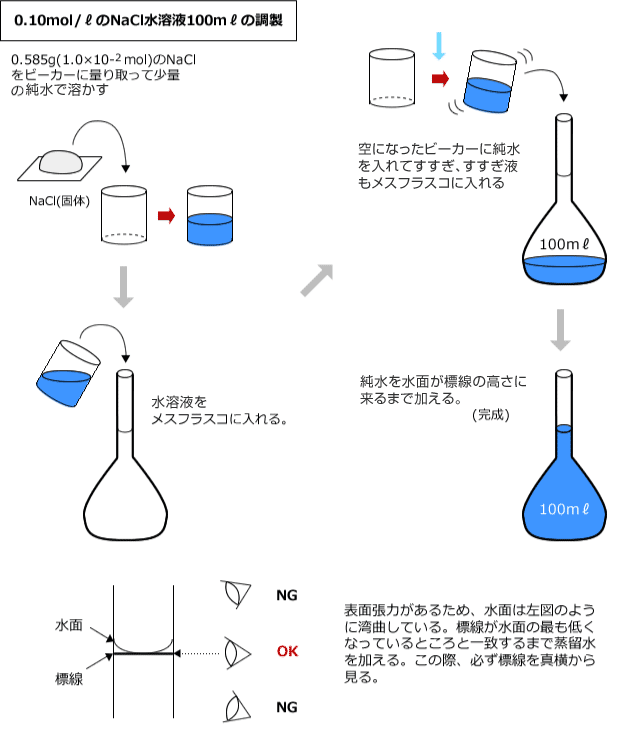
ちなみに、メスフラスコは使用前に洗いますが、ぬれたまま使ってもかまいません。どうせ、その後に水溶液や純水を加えるわけですから。
物質量と体積、質量、原子や分子の個数の関係図
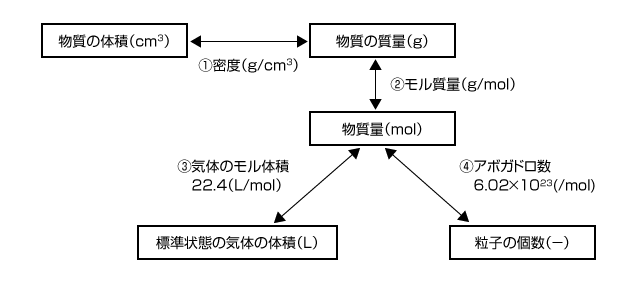
①密度は物質の体積と質量をつなぐ値
密度は単位体積当たりの質量なので、次の関係が成立します。
【物質の質量】=【物質の体積】×【密度】
②モル質量(原子量、分子量、式量などと同じ大きさ)は物質量と物質の質量をつなぐ値
モル質量は、1(mol)の物質の質量なので、次の関係が成立します。
【物質の質量】=【物質量】×【モル質量】
③1(mol)の標準状態の気体の体積は 22.4(L)
標準状態とは0(℃)、1.013×105(Pa) のことで、この時、1(mol)の気体は 22.4(L)を占める。
そのため、次の式が成立します。
【標準状態の気体の体積】=【気体の物質量】×22.4(L)
④1(mol)とは6.02×1023個の集まりのこと
原子や分子などは小さいので 6.02×1023個を1(mol) として数える。そのため、次の式が成立します。
【原子や分子やイオンなどの個数】=【物質量】×6.02×1023
溶液、溶質、溶媒の量の関係図
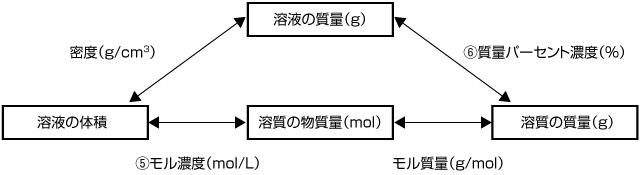
⑤モル濃度は、1(L)の溶液に含まれる溶質の物質量
C(mol/L)の溶液1(L)には、C(mol)溶質が溶けているので、次の式が成立します。
【溶質の物質量】=【溶液の体積】×【モル濃度】
質量パーセント濃度は、100(g) の溶液に含まれる溶質の質量(g)
そのため、次の式が成立します。
【溶質の質量】=【溶液の質量】×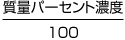
上の図は、溶液における各種の量とその関係です。この関係図がわかっていれば、問題で与えられた値から必要な量を計算することができます。
例えば、溶液の体積から溶質の質量を求めたい場合、与えられた値が密度と質量パーセント濃度であれば、図の上のルートで計算すればよい。
つまり、まず密度を用いて
【溶液の質量】=【溶液の体積】×【密度】 の計算で溶液の質量を求める。
次に、質量パーセント濃度を用いて
【溶質の質量】=【溶液の質量】×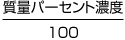 の計算で溶質の質量を求める。
の計算で溶質の質量を求める。





















































