理論化学
化学講座 第13回:化学反応式の問題の解き方
今回から電気分解までは化学反応式を用いていろいろな量(原子量・分子量・体積・質量・物質量・濃度・密度)を求めます。
化学の計算問題、とくに化学反応式の問題が出てくるとお手上げになる。という声を毎年聞きますが、実は、この問題はそんなに難しくありません。
いろいろな問題をたくさん解いていれば、そのうちできるようになるだろうという程度の考え方でやっているからダメなのです。ちゃんとルールを知って、それにのっとって問題に取り組んでいけば、学力は確実に向上します。
さて、化学反応式の解き方は2種類あります。両方とも理論化学を学んでいく間に何度も何度も繰り返す作業ですから、しっかりと覚えておきましょう。
化学反応式の問題の解き方その(1) 反応が過不足なく起こる場合
- 化学反応式を作る
- 知りたい値を文字で置く
- 反応に関わる物質の物質量を求める。(気体なら体積・分圧でもよい)
- 化学反応式の係数から物質量の比の式を作る
実際に例題を解いてみましょう。
例題(1)
ある金属Mの酸化物M2O3 8.5gをコークス(C)で還元したところ、4.5gの金属Mが得られた。この金属の原子量を求めなさい。
(解説・解答)
まずは、化学反応式を作りましょう。金属の酸化物をCで還元すると、Cが酸素と化合してCO2になる一方、金属は還元されて単体となります。これは、知識として知っていなくてはいけません。
ところで、この式は係数が結構複雑になります。最初にこのような化学反応式の係数を決める方法について説明します。
まず、反応物と生成物を書き、係数をα、β・・・と文字でおきます。
αM2O3 + βC → γM + δCO2
次に、左辺で1回しか出てこない元素を含む化合物・単体の係数を1にします。今回は、MもOもCもすべて1回しか出てきませんから、αとβのどちらを1にしてもOKです。
とりあえず、M2O3の係数を1にします。
M2O3 + βC → γM + δCO2 ・・・・ *
つぎに、(左辺の原子数)=(右辺の原子数)という式を、各元素について立てていきます。
金属Mに着目すると、左辺にはM2O3の中に2原子、右辺にはγ原子含まれていますね。
ですから、金属Mについては
(金属M): 2 = γ ・・・・ ①
という式が成立します。
同様に、O、Cについても方程式を立てられます。
(酸素O): 3 = 2δ ・・・・ ②
(炭素C): β = 2δ ・・・・ ③
①、②、③を解くと、β=3、γ=2、δ=![]() となりますから、これを*に代入すると
となりますから、これを*に代入すると
M2O3 + 3C → 2M + ![]() CO2
CO2
という式が得られます。
化学反応式の係数は、整数にしなくてはいけません。分数のままではダメですから、この式の両辺を2倍して、分母を払えば化学反応式の完成となります。
2M2O3 + 6C → 4M + 3CO2
このような係数の決め方を、ラグランジュの未定係数法といいます。
ラグランジュの未定計数法
- 左辺に反応物、右辺に生成物を書き、矢印でつなぐ。
- 各物質の係数を文字で置く。
- 左辺に1回しか出てこない元素(無ければ、右辺に1回しか出てこない元素)の係数を1とする。
- 各元素について、数が同じになるように等式をつくる。
では、例題に戻ります。
先ほど作った化学反応式の、各化合物の下に、それぞれ条件として与えられている質量を書きます。
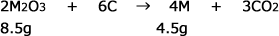
次に、Mの原子量をmとおきます。これが求めたい値ですね。この値を用いて物質量を求めます。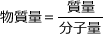 を用いて物質量を求め、それを質量の下に書きます。
を用いて物質量を求め、それを質量の下に書きます。
M2O3の分子量は2m+16×3ですから、8.5gのM2O3は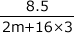 mol、また、4.5gのMは
mol、また、4.5gのMは![]() molですね。
molですね。
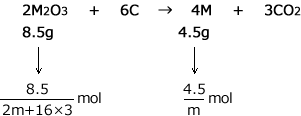
最後に、化学式の係数比から物質量の比の式をつくります。この問題では係数からM2O3とMが 2 : 4 の割合になることがわかりますので次のようになります。
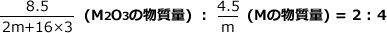
これを解くと、mが求まります。m ≒ 27
求める値が、原子量でも体積でも質量でも、やり方は全て同じです。
気体についても1問やっておきましょう。こちらは、標準状態で1molの気体が22.4ℓを占めることを使って物質量を出して比の式を作ります。
例題(2)
標準状態で5.6ℓのN2をH2と反応させてNH3を作るとき、必要なH2の標準状態における体積と生じるNH3の質量を求めなさい。
(解説・解答)
まず化学反応式を書きます。これは、ハーバー・ボッシュ法というNH3の製法です。
N2 + 3H2 → 2NH3
必要なH2の標準状態における体積をvℓ、得られるNH3の質量をa gとします。
標準状態とは0℃、1気圧(1.013×105Pa)の事ですが、この状態では1molの気体は、種類によらず22.4ℓとなるんでしたね。ですから、5.6ℓのN2の物質量は![]() molですね。
molですね。
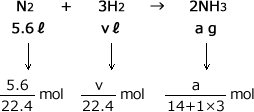
最後に、化学式の係数比から物質量の比の式を作ります。
係数比は
なので
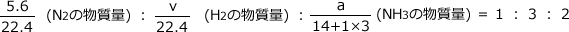
これを解くと、v=16.8ℓ、a=4.25 mol となります。
(別解)
標準状態で1molの気体の体積は、種類のよらず22.4ℓで一体ですから、物質量の比と体積の比は同じになります。
ですから、標準状態の気体を考える場合は、物質量をわざわざ求めなくても、体積の比を作る事で化学反応式の問題を解くことができます。
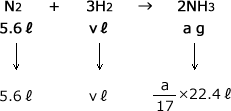
化学式の係数比から体積の比の式を作ります。
係数比はN2:H2:NH3=1 : 3 : 2なので
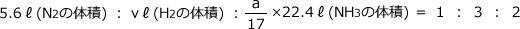
これを解くと、v=16.8ℓ、a=4.25 mol となります。
どうでしょうか、結構簡単ですよね。では、もう少し複雑な問題もやってみましょう。
例題(3)
質量百分率で64%の硫黄を含む鉱物がある。この1kgを用いて硫酸を作り、これにアンモニアを加えて硫酸アンモニウムを作ったとすると、得られる硫酸アンモニウムは理論上何gか。有効数字2ケタで答えよ。
(解説・解答)
今回は、反応が複雑ですね。接触法で硫酸を作る場合、硫黄の単体を燃焼させてSO2を作り、これを酸化して三酸化硫黄をつくり、これを濃硫酸に吸収させた後、希硫酸で希釈します。下線部については、本質的には水に吸収させているだけですから、この問題では水との反応と考えます。
まず反応式を書いてみます。
- 硫黄の燃焼
S + O2 → SO2 - 二酸化硫黄の酸化
2SO2 + O2 → 2SO3 - 水との反応
SO3 + H2O → H2SO4 - アンモニアとの反応
H2SO4 + 2NH3 → (NH4)2SO4
そうすると、4本も式が出てきて、これを解くのは実に大変そうです。例題(1)、(2)の作業を4回も繰り返すなんて、ちょっと考えたくないですよね。
そこで、このように反応が複数の段階に分かれていて複雑な場合は、主要な元素のみに着目して、比の式を作ります。
今回は硫黄が問題になっているわけですから、硫黄に着目します。そうすると
S → SO2 → SO3 → H2SO4
というように変化していますから、実は1molのSから1molのH2SO4が生じる事が分かります。
という事は、硫黄の含有率64%、質量1㎏の中に含まれるSは640g、Sの原子量は32ですから、Sは![]() =20molあるわけです。したがって、H2SO4は20mol生じる事が分かります。
=20molあるわけです。したがって、H2SO4は20mol生じる事が分かります。
また、(4)式の係数から1molのH2SO4から 1molの(NH4)2SO4が生じますので、この反応で生じる(NH4)2SO4は20molです。
硫酸アンモニウムの式量は132なので、硫酸アンモニウムは132×20=2640≒2.6×103g生じる。
この解説では最後の所だけ分けましたけれども、一息でやると次のようになります。
硫黄に着目すると
S → SO2 → SO3 → H2SO4 → (NH4)2SO4
すると、1molの硫黄原子から1molの硫酸アンモニウムが生じます。
従って、硫酸アンモニウムの生成量=硫黄の物質量=![]() =20mol
=20mol
硫酸アンモニウムの式量を考えて132×20=2640≒2.6×103g
どうでしたか?このように過不足なく反応する場合には、物質量を求めて比の式を作るというものすごく簡単な方法で問題が解けてしまうのです。
次に、もう一つのパターン、反応で過不足が起こる(反応物か生成物のどちらかが余る)場合や平衡になる場合に有効な、反応前後の物質量の表を描くというパターンについて説明します。
化学反応式の問題の解き方その(2) 過不足が生じたり平衡になる場合
- 化学反応式を作る
- 知りたい値を文字で置く
- 反応前後の物質量を書き込む表を作り、各物質量を計算してそこに入れる。
- 化学反応式の係数から物質量の比の式などを作る。
実際に例題を解いてみましょう。
例題(4)
純粋な炭酸カルシウム18gに8.0%の塩酸200gを注いだとき、発生する二酸化炭素は標準状態で何ℓか。有効数字2桁で答えよ。
(解説・解答)
よくあるひっかけ問題です。実はHClが過剰で、炭酸カルシウムが全部反応してもHClが余ります。
CaCO3の式量は100ですから18gのCaCO3は0.18molですね。
一方で、HClは200×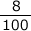 =16g
=16g
HClの分子量が36.5なので物質量は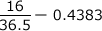 ・・・≒0.438mol
・・・≒0.438mol
※答えを有効数字2桁で出すなら、途中の計算は3桁で行えば十分です。
さて、ここまで求めたところで、HClの方が余るなぁ・・・と感じてほしいです。
というのも、CaCO3は2価の塩基として働くから、HClとCaCO3は1:2の割合で反応するはずですよね。0.438は0.18の2倍の0.36より多いですから、HClが過剰です。
この程度なら、暗算でやっても構わないですが、練習のために表を描いてやってみます。
まずは反応式を書きます。
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
次に、一番上の行に物質、その下に反応前の各物質の物質量、もう1つ下に反応後の各物質の物質量を書きます。
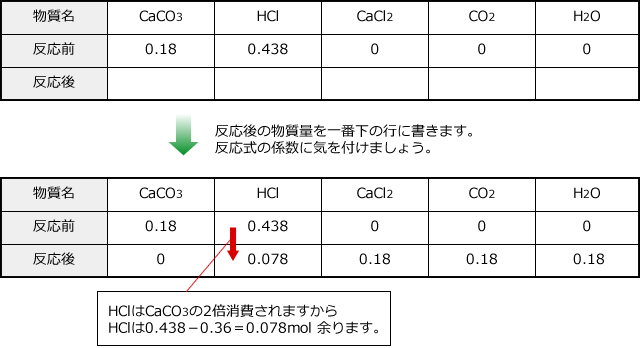
よって、CO2は0.18×22.4=4.038≒4.0ℓ発生します。
最後に気体反応の少し面倒なものをやっておきましょう。表を描くことでどれほど楽になるかが分かると思います。
例題(5)
メタン、一酸化炭素、酸素の混合気体100mℓに添加して完全燃焼した後乾燥したところ、気体の体積は75mℓになった。この気体を水酸化ナトリウム水溶液に通して二酸化炭素を吸収させたところ、気体の体積は15mℓになった。最初の混合気体中の各成分の体積を求めよ。この実験を通じて温度・圧力は一定であるとする。反応後にはメタンも一酸化炭素も残っていないとする。
(解説・解答)
なんだか難しそうな問題ですね。こういう問題ではまず文字で置くことが大切です。温度圧力一定ですから、体積を物質量の代わりに使っても構いませんね。点火前のメタンの体積をAmℓ、一酸化炭素の体積をBmℓ、酸素の体積をCmℓとします。
まず、最初の体積が100mℓでしたからA+B+C=100・・・①
※このような最初に存在していた量についての式は結構重要です。
次に化学反応式を書きます。
メタンの燃焼 CH4 + 2O2 → CO2 + 2H2O
一酸化炭素の燃焼 2CO + O2 → 2CO2
この反応式から、1mℓのメタンと2mℓの酸素が反応し、2mℓの一酸化炭素と1mℓの酸素反応することが分かります。
また、メタンも一酸化炭素も残っていませんから、酸素の消費量はメタンによって2Amℓ、一酸化炭素によって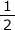 Bmℓとなりますね。残った酸素の量はC-2A-
Bmℓとなりますね。残った酸素の量はC-2A-![]() Bmℓです。
Bmℓです。
ちょっとごちゃごちゃしてきました。表を描きましょう。
| 物質名 | CH4 | CO | O2 | CO2 | H2O |
|---|---|---|---|---|---|
| 反応前 mℓ | A | B | C | 0 | 0 |
| 反応後 mℓ | 0 | 0 | Cー2Aー |
A+B | 2A |
こうするとすっきりしますね。さて、反応後の気体からH2Oを抜いたものが75mℓなので、
C-2A-B+A+B=C-A+![]() B=75mℓ・・・②
B=75mℓ・・・②
ここから水酸化ナトリウムを使って二酸化炭素を吸収させると15mℓがのこります。つまり、二酸化炭素は35mℓあったわけですから、A+B=15mℓ・・・③
①、②、③よりA=15 mℓ、B=10 mℓ、C=75mℓ
さて、今回はどうでしたか?最後は結構難しい問題でしたが、表を描いて整理するとものすごく分かりやすくなったと思います。次回から酸と塩基の話に入りますが、中和滴定や酸化還元滴定、電気分解などの問題では今日やったことが応用としてどんどん出てきます。
ですから、今日の内容はちゃんと復習をして身に付けておいてくださいね。





















































