理論化学
化学講座 第14回:酸と塩基(1)
今回から酸と塩基のお話をしていきます。この分野のクライマックスは中和滴定ですが、まずは用語の定義などの周辺知識からやっていきましょう。
酸と塩基の定義
高校で出てくる酸と塩基の定義は2つ、アレニウスの定義とブレンステッド・ローリーの定義です。
アレニウスの定義は1884年、ブレンステッド・ローリーの定義は1923年に発表されました。
当然、新しい定義であるブレンステッド・ローリーの定義はアレニウスの定義を含んでいますが、なぜ新しい定義が必要になったのでしょうか。そのあたりのいきさつも交えながらこの二つの定義を説明していこうと思います。
(1) アレニウスの定義
アレニウスの定義(1884年)
酸は、水溶液中でH+を放出する物質。
塩基は、水溶液中でOH-を放出する物質。
アレニウスの定義は水溶液中の溶質についての定義です。水中で電離するHClやNaOHなどにはぴったり当てはまってわかりやすい定義ですね。
例えば、塩化水素は水中で以下のように電離してH+を放出します。ですから、塩化水素は酸です。
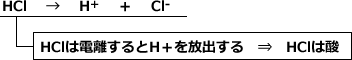
また、NaOHは水中で以下のように電離してOH-を放出しますから、塩基です。
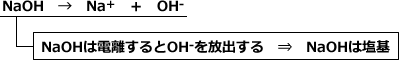
しかし、この定義ではNH3が水に溶けたときに塩基性を示す事が説明できません。というのも、NH3は分子のどこにもOH-を持っていませんよね。ですから、「OH-を放出するものが塩基」という定義ではNH3が塩基であるということを説明できないのです。
NH3とH2Oの反応
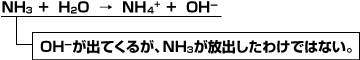
また、気体や固体の酸・塩基の反応についても説明する事ができません。
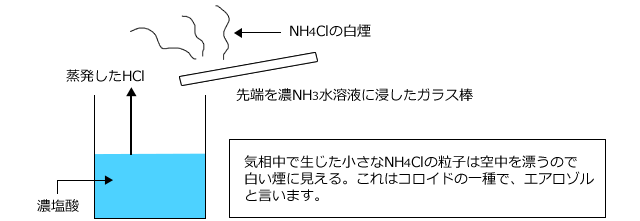
たとえば、HClとNH3の気相中での反応です。これは結構重要な反応ですから、覚えておいてください。濃塩酸のビーカーの上に、濃アンモニア水に浸したガラス棒を近づけると、ガラス棒から白煙が生じます。これは、こまかいNH4Clの粒子です。
この反応式は、HCl + NH3 → NH4Cl です。酸であるHClとNH3の反応ですが、気相中で起こった反応なので、水溶液中の溶質についての定義であるアレニウスの定義では説明することができませんよね。
そこで出てきたのがブレンステッド、ローリーの定義です。この定義を使えば、NH3水溶液が塩基性であることや、気体のHClとNH3の反応が酸・塩基の反応である事を説明する事ができます。
(2) ブレンステッド・ローリーの定義
ブレンステッド・ローリーの定義(1923年)
酸は、H+を放出する物質。
塩基は、H+を受け取る物質。
まず、NH3水溶液から考えてみましょう。NH3は水に溶けると以下のようにH2Oと反応をします。

この反応では、H2OがH+を放出してそれをNH3が受け取り、OH-とNH4+になるのです。ですから、ブレンステッド・ローリーの定義に従うと、NH3が塩基として働き、H2Oが酸として働いた事になりますよね。
え、水が酸?と思うかもしれませんが、水はH+を与えることもH+をうけとることもできるので酸としても塩基としても働く物質です。
次は酸を水に溶かした場合を考えてみましょう。
酸はH+を放出しますが、H+はH原子が電子を1つ失ったものですね。これは、陽子そのものです。こんなものはとても不安定で、存在したとしても一瞬しか存在できません。これが多く存在するのは、太陽の中くらいのものです。(地球上でこれを安定的に作ろうというのが核融合炉です。酸を水に溶かすたびにこんなものが出てくるはずなんてないですよね。)
ですから、水溶液中にはH+は存在しません。では、水溶液中で酸が放出したH+はどうなっているのかというと、水分子とくっついて安定化しているのです。
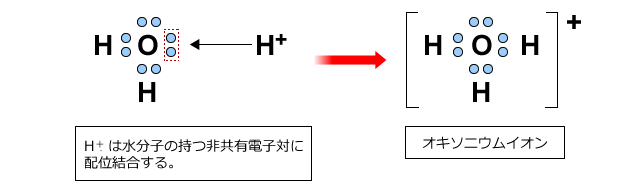
上図のように、水の非共有電子対にH+が結びつき、電子対を共有することで結びつきます。このように一方の非共有電子対を共有する結合を配位結合といいましたね。この結果生じるH3O+をオキソニウムイオンといいます。
さて、もう分かったと思いますが、HClが水に溶けると、HClがH2OにH+を与える事になります。ということは、この場合はHClが酸でH2Oが塩基として働く事になります。

ですから、H2Oという物質は相手がNH3のときは酸として、相手がHClのときは塩基として働く事になります。
このようにブレンステッド・ローリーの定義では、同じ物質でも反応する相手によって、酸・塩基のどちらとして働くのかが変わります。
次に、気体のNH3とHClの反応を考えてみましょう。
NH3 + HCl → NH4Cl
この反応も同じように考える事ができます。NH4Clはひとかたまりの物質のように書いてありますが、これは、NH4+とCl-がイオン結合してできた物質でしたね。
さて、そうすると、この反応ではHClがH+を放出して、それをNH3が受け取ったと考えられます。したがって、NH3が塩基、HClが酸ということになるわけです。

酸性と塩基性
酸の水溶液の性質を酸性、塩基の水溶液の性質を塩基性といいます。これは時々問われますから、覚えておきましょう。
(1) 酸性とはH+の示す性質
- 青色リトマス紙を赤変させる
- BTB溶液を黄色にする
- なめるとすっぱい味がする
- 金属と反応して水素を発生する
(2) 塩基性とはOH-の示す性質
- 赤色リトマス紙を青変させる
- BTB溶液を青色にする
- なめると苦い味がする
- 手につくとぬるぬるする
あとは身近にある酸性の物質や塩基性の物質も知っておきましょう。酸性の物質の例としてはレモンや酢などです。あとは胃液も酸性なんですよ。塩基性の物質の例としてはせっけんや植物の灰などがあげられます。
新課程になって身の回りの物質についての問いが増えそうです。図説などを読みながら、なんとなく雑学に近いそういう知識も増やしておいた方がいいでしょうね。
酸と塩基の強弱・価数
高校化学では酸は強酸と弱酸、塩基は強塩基と弱塩基という2つのカテゴリにおおざっぱに分類されます。
強酸・強塩基というのは、薄い水溶液にしたとき(高校では、水溶液は全て薄いという仮定の下で議論しています。濃度が濃くなると、高校の知識の範囲では議論しきれなくなります。)に水中で完全に電離する酸・塩基の事です。弱酸・弱塩基は、溶けている溶質の一部だけが電離する酸・塩基の事で、電離する割合の事を電離度と言います。
強酸は、塩化水素、硝酸、硫酸の3種類に臭化水素、ヨウ化水素、ベンゼンスルホン酸、ピクリン酸を加えた7種類です。他は全部弱酸です。強塩基は、NaOHなどのアルカリ金属の水酸化物とCa(OH)2などのアルカリ土類金属の水酸化物で、そのほかは全部弱塩基です。また、気体の弱塩基はNH3しかないので注意しましょう。
酸や塩基は1分子が1つだけH+やOH-を放出するとは限りません。例えば、HClは、水中でHCl → H+ + Cl- のように電離して、1分子のHClが1つのH+を放出します。一方、H2SO4は、H2SO4 → H+ + SO42- のように電離して、1分子のH2SO4が2つのH+を放出します。
このように1分子が複数のH+やOH-を放出する酸や塩基もあるのです。1分子の酸あるいは塩基から放出されるH+あるいはOH-の数を価数といいます。上の例で言えば、HClは一価の酸、H2SO4は二価の酸という事になります。まぁ、分子式を見れば価数はすぐにわかりますよね。
次に示す代表的な酸・塩基はその強と価数を覚えておきましょう。
代表的な酸
| 一価の酸 | 二価の酸 | 三価の酸 | |||
|---|---|---|---|---|---|
| 硝酸 | HNO3 | 硫酸 | H2SO4 | リン酸 | H3PO4 |
| 塩酸 | HCl | 亜硫酸 | H2SO3 | ||
| 臭化水素酸 | HBr | 炭酸 | H2CO3 | ||
| ヨウ化水素酸 | HI | 硫化水素 | H2S | ||
| ベンゼンスルホン酸 | C6H5SO3H | シュウ酸 | (COOH)2 | ||
| フッ化水素酸 | HF | ||||
| ギ酸 | HCOOH | ||||
| 酢酸 | CH3COOH | ||||
| フェノール | C6H5OH | ||||
代表的な塩基
| 一価の酸 | 二価の酸 | 三価の酸 | |||
|---|---|---|---|---|---|
| 水酸化 リチウム |
LiOH | 水酸化 カルシウム |
Ca(OH)2 | 水酸化鉄(III) | Fe(OH)3 |
| 水酸化 ナトリウム |
NaOH | 水酸化 バリウム |
Ba(OH)2 | 水酸化 アルミニウム |
Al(OH)3 |
| 水酸化 カリウム |
KOH | 水酸化 ストロンチウム |
Sr(OH)2 | ||
| アンモニア | NH3 | 水酸化銅 | Cu(OH)2 | ||
中和反応
酸と塩基はお互いに出会うと、その性質を打ち消しあいます。これは、酸の放出するH+と塩基の放出するOH-(高校では、溶液中の酸と塩基の反応について、アレニウスの定義で考えます。そのほうが楽だからです。)が反応して、H2Oになってしまうからです。例えば、HClとNaOHが出会うと、次のような反応を起こしてH2OとNaClになってしまいます。
このように水中でH+とOH-が反応してH2Oになる反応を中和反応と言います。
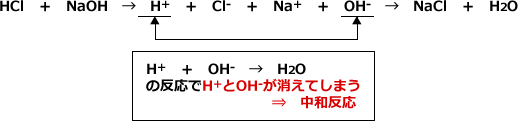
このとき、水以外に生じた物質を塩といいます。この反応の場合はNaClですが、NaClは塩のなかでも、食用に使うものですから、食塩といいます。
中和反応は、酸が放出するH+の数と、塩基が放出するOH-の数が等しくなるように反応します。
ですから、中和反応の化学反応式は酸が電離する反応式と、塩基が電離する反応式を並べて書いて、酸が放出するH+の数と塩基が放出するOH-の数が等しくなるように足し合わせれば作る事ができます。
ちょっと練習してみましょう。
例題(1)
硫酸と水酸化ナトリウムの中和反応の反応式を書きなさい。
(解説・解答)
硫酸は水中でH2SO4→SO42-+2H+ ・・・ ①というように電離します。
水酸化ナトリウムは水中でNaOH→Na++OH- ・・・ ②というように電離します。
つまり、硫酸は1分子から2つのH+を、水酸化ナトリウムは1つのOH-を放出します。
H+とOH-の数を等しくして①と②を足せば良いのですから、①+②×2をします。
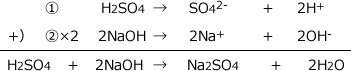
例題(2)
塩酸と水酸化カルシウムの中和反応の反応式を書きなさい。
(解説・解答)
塩酸は水中でHCl→Cl-+H+ ・・・ ①というように電離します。
水酸化カルシウムは水中でCa(OH)2→Ca2++2OH- ・・・ ②のように電離します。
つまり、塩酸は1分子から1つのH+を、水酸化カルシウムは2つのOH-を放出します。
H+とOH-の数を等しくして①と②を足せば良いのですから、①×2+②をします。
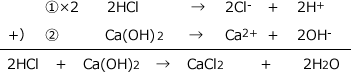
以上のように、中和反応では次の等式が成立するように係数を決め、H+とOH-の数を同じになるようにします。
(酸の価数)×(反応式中の酸の係数)=(塩基の価数)×(反応式中の塩基の係数)
この式を使えば、例題①、②のように面倒なことをしなくても
①の反応が H2SO4 + 2NaOH → Na2SO4 + 2H2O
②の反応が 2HCl + Ca(OH)2 → CaCl2 + 2H2O
と表される事はすぐに分かりますよね。
今回はこれでおしまいです。それでは、また。





















































