理論化学
化学講座 第17回:酸と塩基(4)
中和滴定は、中和反応を使って濃度の分からない酸や塩基の濃度を求める方法です。
第15回で学習したように、酸に塩基を加えていくと、いずれ滴下したH+とOH-の物質量が同じになります。そうするとpHが大きく変化しするのでした。その変化が起こる瞬間を見つけることができれば、加えたOH-の物質量から酸の物質量を求めることができて、その値から酸の濃度を求めることができます。濃度のわからない塩基の場合は酸を加えて同じことをすればOKです。
しかし、単に酸と塩基を反応させてみても、H+とOH-の物質量が同じになった瞬間を見た目で判断することはできません。
そこで、指示薬というものを使います。指示薬はpHの変化によって色が変わる物質で、メチルオレンジ・メチルレッド・フェノールフタレイン・BTB(ブロモチモールブルー)の4種類があります。
今回は中和滴定の理論と実験方法について説明します。まず、第15回で説明した中和点について復習しておきましょう。
● 中和点・・【酸の放出するH+の物質量】と【塩基の放出するOH-の物質量】が等しくなる点※
【酸の放出するH+の物質量】=(酸の物質量)×(価数)
【塩基の放出するOH-の物質量】=(塩基の物質量)×(価数)
※高校の中和滴定の問題では3レニウスの定義で考える方が、ブレンステッドの定義で考えるより理解しやすい。
では、中和点でHとOHの物質量が等しくなるという関係をもちいて、濃度未知の酸の濃度を求める方法を考えてみましょう。
濃度の分からないn1価の酸の水溶液がv1(mℓ)あったとして、これを中和するのにc(mol/ℓ)のn2価の塩基がv2(mℓ)必要であったとします。
とりあえず、酸の濃度をχ(mol/ℓ)とおきます。

となります。中和点は【酸の放出するH+の物質量】と【塩基の放出するOH-の物質量】が等しくなる点ですから、①=②が成立します。
①=②(【酸の放出するH+の物質量】=【塩基の放出するOH-の物質量】)より
(χ×![]() )×(n1)=(c×
)×(n1)=(c×![]() )×(n2)
)×(n2)
これをχについて解けば、酸の濃度が分かるわけです。
例題をやってみましょう。
例題
濃度不明の塩酸10(mℓ)を完全に中和するのに0.010(mol/ℓ)のNaOHが20(mℓ)必要であった。塩酸の濃度を求めなさい。
(解説・解答)
塩酸の濃度をχ(mol/ℓ)とおく。HClもNaOHも価数は1ですね。
【酸の放出するH+の物質量】=χ×![]() ×1 mol
×1 mol
【塩基の放出するOH-の物質量】=0.01×![]() ×1 mol
×1 mol
この2つが等しくなるから、χ×![]() ×1 = 0.01×
×1 = 0.01×![]() ×1
×1
これを、χについて解くと、χ=0.020(mol/ℓ)
このように、中和反応の問題では、中和点で成立する関係【酸の放出するH+の物質量】=【塩基の放出するOH-の物質量】の式を立てて、これを解けばよいのです。
弱酸や弱塩基の電離度は考える必要があるのか
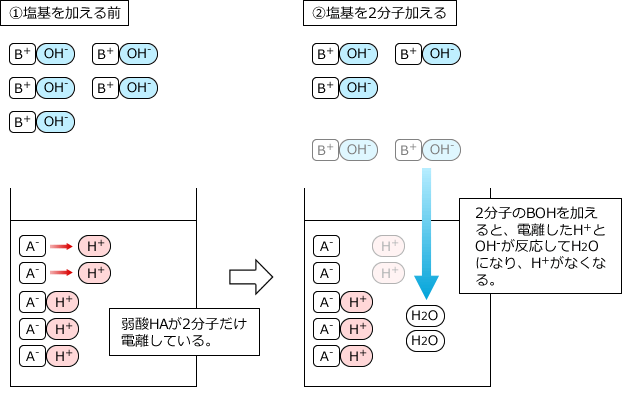
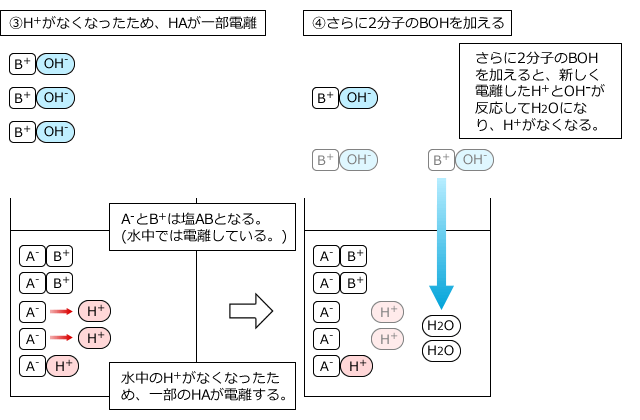
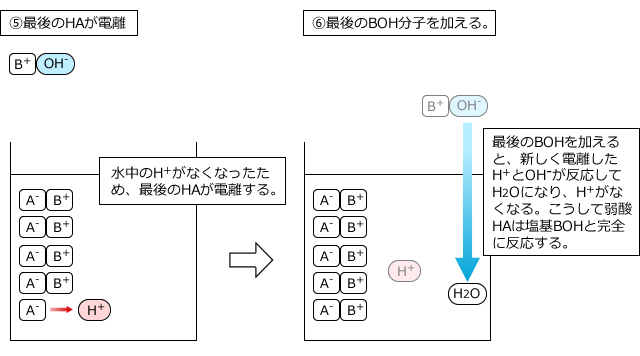
中和滴定では、弱酸や弱塩基の電離度は全く無視して、弱酸や弱塩基も全部反応すると考えてOKです。なぜなら、電離して生じているH+やOH-が反応してなくなってしまうと、電離していなかったものが電離してH+やOH-を供給するからです。それも反応するとまた、残ったものが電離して・・・というのを繰り返すので、結局、最後まで全部反応してしまうからです。
5分子の弱酸HAと5分子の塩基BOHが反応する様子を例にして説明します。
指示薬と中和点
さて、このように、中和反応を用いて濃度の分かっていない酸や塩基の濃度を求める事ができる事がわかりました。しかし、これはまだ不十分です。最初に説明したように、中和点で色の変化が起こったり、突然沈殿が生じたりするわけではないので、中和点に達した瞬間を知る事ができないからです。
そこで、中和点のあたりではpHが大きく変わることに着目して、そのあたりで色の変化が起こるような物質を加えておけば、溶液の色の変化によって、中和点に達した瞬間を見極めることができます。このような物質を、指示薬と言います。
高校で出てくる指示薬にはフェノールフタレイン(p.p)メチルオレンジ(M.O)メチルレッド(M.R)ブロモチモールブルー(BTB)の4種類があります。それぞれ色の変化するpH(これを変色域といいます)が異なります。色の変化とともに覚えておきましょう。
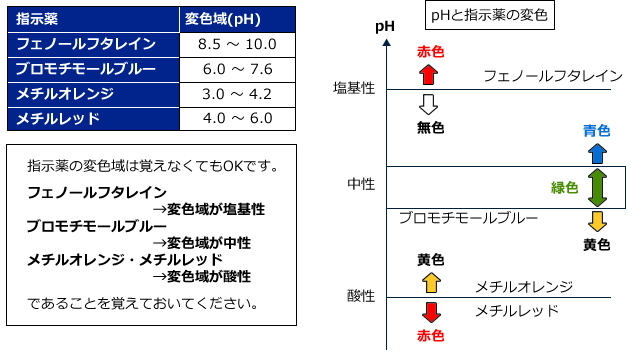
BTBは中和滴定の指示薬としてはほとんど用いられません。というのも、BTBは色の変化があまり鋭敏でないからです。徐々に色が変わっていく感じで、酸性・塩基性の判定には用いられますが、中和点をピンポイントで求めるのには適していないのです。
では、どのような酸・塩基の組み合わせのときに、どの指示薬を使えばよいか、滴定曲線を見ながら説明します。
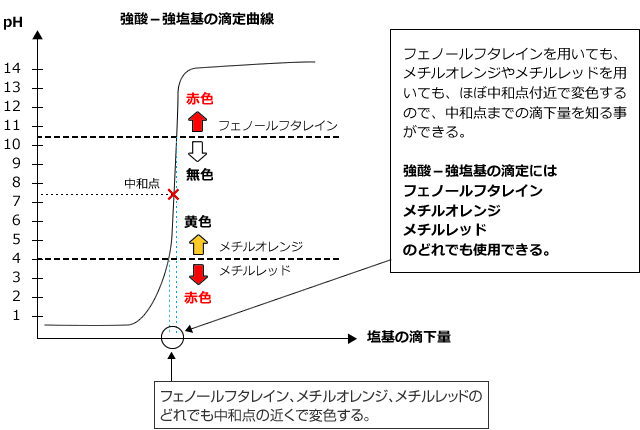
1)強酸に強塩基を加えたとき
強酸に強塩基を滴下した時の滴定曲線は下図のようになります。
中和点は中性で、pHjumpはものすごく大きく、酸性から塩基性までpHが大きく動きますから、フェノールフタレインを用いても、メチルレッドやメチルオレンジを用いても、色の変化で中和点を知ることができます。
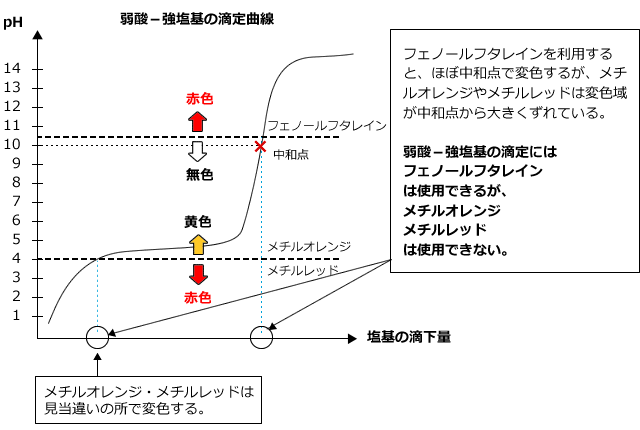
2)弱酸に強塩基を加えたとき
弱酸に弱塩基を加えた時の滴定曲線は下図のようになります。
生じる塩は塩基性ですから、中和点での液性は塩基性で、pHjumpは塩基性側で起こります。また、pHの変化は強酸・強塩基の滴定のときのように大きくはありません。したがって、メチルレッドやメチルオレンジを用いると、中和点とは関係のないところで色が変化してしまい、正しく測定する事ができません。弱酸に強塩基を滴下する場合は、フェノールフタレインのみが中和点を求めるために使えます。
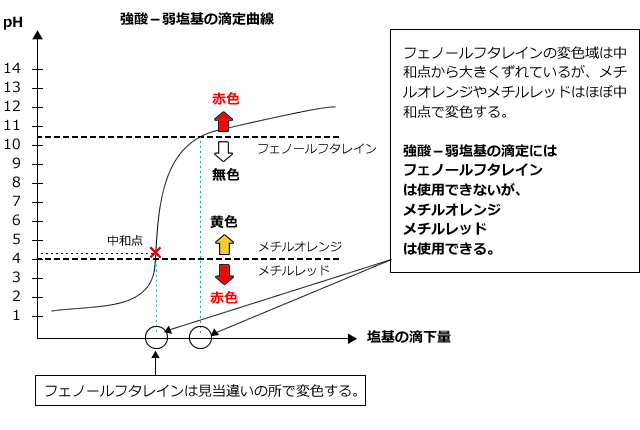
3)強酸に弱塩基を加えるとき
強酸に弱塩基を加えた時の滴定曲線は下図のようになります。
生じる塩は酸性ですから、中和点での液性は酸性でpHjumpは酸側で起こります。また、pHの変化は強酸・強塩基の滴定のときのように大きくはありません。したがって、フェノールフタレインを用いると、中和点とは関係のないところで色が変化してしまい、正しく測定する事ができません。弱酸に強塩基を滴下する場合は、メチルオレンジ・メチルレッドを使うと中和点を求めることができます。
このように、指示薬によって、中和点を求め、濃度の分からない酸や塩基の濃度を求める事ができます。
酸・塩基の組み合わせと利用できる指示薬について、もう一度まとめておきますね。
| 酸と塩基の組み合わせ | 変色域 | pH jump | 使用する指示薬 |
|---|---|---|---|
| 強酸・強塩基 | 中性 | 大きい | フェノールフタレイン メチルオレンジ・メチルレッド |
| 強酸・弱塩基 | 酸性 | 小さい | メチルオレンジ・メチルレッド |
| 弱酸・弱塩基 | 塩基性 | 小さい | フェノールフタレイン |
中和滴定の操作①【器具の取り扱い方法】
中和点を正確に知るためには、滴下量を少しずつ増やしながら実験をしなくてはいけません。ちょっと考えれば分かる話ですが、ビーカーとかでドバッと加えたりしたら、加えた体積を体積に知ることなどできるはずがありませんよね。
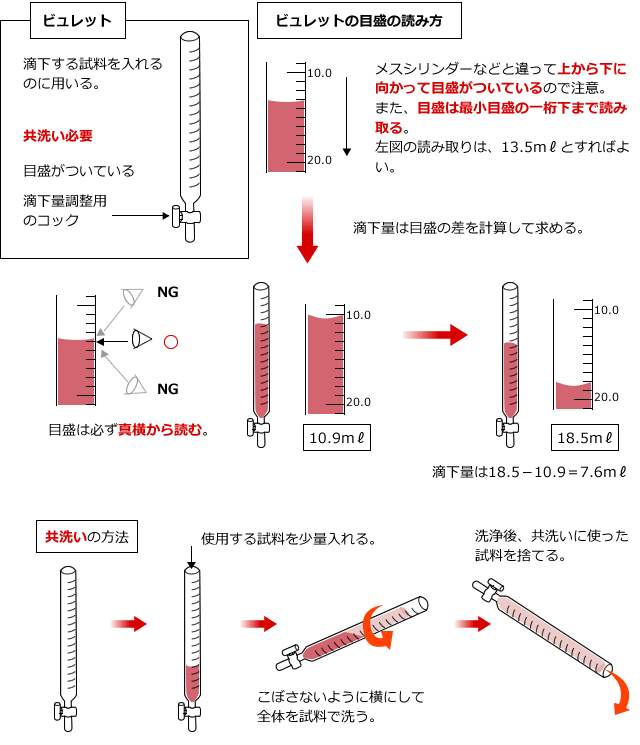
そこで、滴下する水溶液は、ビュレットという器具を使って滴下していきます。これは目盛りのついた細いガラス管で、下に滴下量を調整するためのコックがついているものです。コックを操作して、滴下量を調整しながら目盛りを読んで滴下量を調べます。
ビュレットを使用するときは、使用する溶液であらかじめ内部を洗います。これを共洗いと言い、ビュレットと、後で出てくるホールピペットは使用する前に共洗いが必要です。
滴定される水溶液は、コニカルビーカー(三角フラスコでも可)に入れて、ビュレットの下におきます。
コニカルビーカーも使用する前に洗いますが、これは共洗いをしてはいけません。そんなことをしたら、ビーカーの中に試料溶液が付着してしまい、せっかくホールピペットで正確に溶液を量り取ったのが無駄になってしまいますよね。でも、水でぬれているのはOKです。というのも、コニカルビーカーにホールピペットで試料溶液を量り取った時点で、その中に入っている酸や塩基の物質量が決まっているからです。
もう1つ、濡れたまま使っていい器具にメスフラスコがありましたね。メスフラスコの使い方は第12回で詳しく解説しましたので、そちらを参照してください。
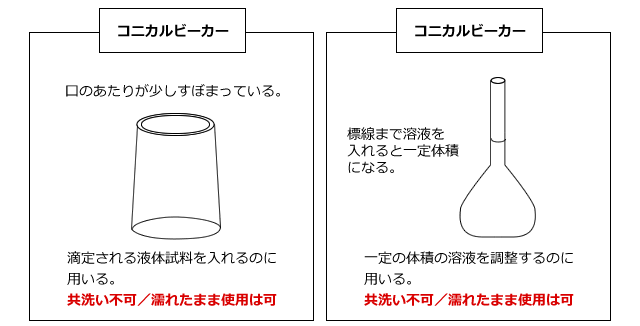
コニカルビーカーに入れる水溶液はホールピペットで取ります。ホールピペットは体積を正確に測定してはかり取るための器具で、中央が少し膨らんだ筒状のガラス器具です。ふくらみの上の方の、ガラス管が細くなったところに一カ所だけ標線がついています。この線まで溶液を入れると、正確に体積を測定することができるのです。
ホールピペットもビュレット同様に共洗いをします。そうすることによって内部に付着した水滴などによって試料の濃度が変化してしまうことを防ぐわけです。
ホールピペットから溶液を速く滴下しようとしてあるいは先端に少量のこった溶液を落とそうとして、口で吹いたりしてはいけません。
なぜなら、ビュレットの体積はガラス表面にのこる溶液の体積も考慮して決められており、口で吹いたりすると、このガラス表面にのこった溶液も落ちてしまい誤差になるからです。
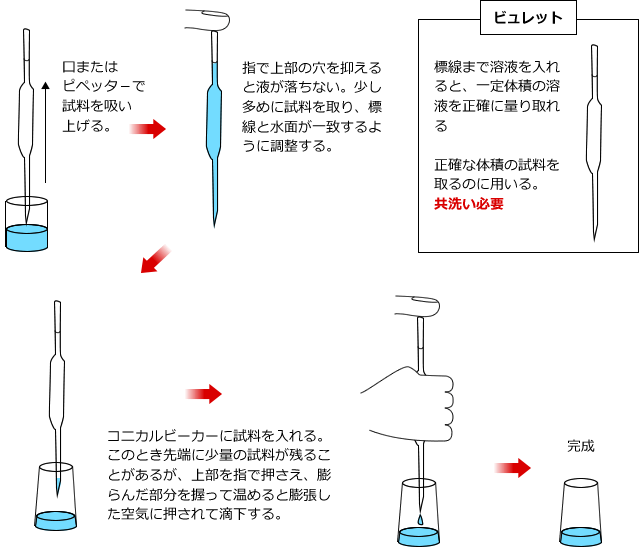
これで器具の使い方はおしまいです。ちゃんと頭に入りましたか?あ、そうそう。ホールピペットやメスフラスコやビュレットのように、精密に体積を測定するガラス器具は絶対に加熱してはいけません。
加熱するとガラスが変形してしまって、微妙に体積が変化してしまうからです。うっかりと加熱乾燥器にかけてしまうと使い物にならなくなってしまうんです。
中和滴定の操作方法②【滴定の方法】
濃度未知の酢酸水溶液をNaOH水溶液で滴定するときの操作を例として中和滴定での操作を説明します。弱酸を強塩基で滴定するので、指示薬にはフェノールフタレインを用います。
滴定される溶液の酢酸水溶液をコニカルビーカー、滴定する溶液のNaOH水溶液をビュレットに入れて実験を始めます。
指示薬をコニカルビーカーの中の酢酸水溶液に加えます。(当然、ビュレットに入れてはいけません。NaOH水溶液の濃度が変化してしまいます。)
ビュレットをクランプで固定したら、NaOH水溶液を滴下します。
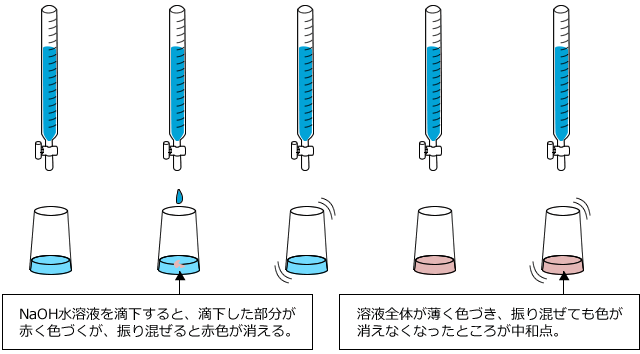
滴下し始めると、滴下したあたりが赤く色づきますが、ビーカーを振り混ぜると反応が進んで色が消えます。ここからさらに滴下を続けると、溶液全体が薄い赤色になって、振り混ぜても色が消えなくなります。この時が中和点です。
コニカルビーカーを振り混ぜる代わりに、マグネチックスターラ―という器具を使うと撹拌が自動的に起こり、実験が楽になります。これは小さな磁石棒をコニカルビーカーに入れ、回転する磁石が仕込まれた台に載せるもので、スイッチを入れると台の中の磁石が回転し、自動的に溶液が撹拌されるという器具です。
今回はちょっと長かったですね。お疲れ様でした。
次回はもう少し応用的な中和滴定について取り扱おうと思います。