理論化学
化学講座 第22回:酸化と還元④
酸化還元反応を用いて、酸化剤や還元剤の濃度を求める操作を酸化還元滴定といいます。酸化還元滴定には、大きく2つに分けて、過マンガン酸滴定とヨウ素滴定があります。
中和滴定に比べて数が少ないのは、酸化還元反応には適当な指示薬が無く、この二種類のみが当量点を色の変化で判別できるためです。
今回は、この2つの滴定のうち、過マンガン酸滴定について説明します。
過マンガン酸滴定の理論
過マンガン酸イオン (MnO4-) は赤紫色ですが、マンガン(Ⅱ)イオン (Mn2+) は無色です。ですので、過マンガン酸イオンを含む水溶液を還元剤を含む水溶液に滴下すると、当量点で色が無色から薄い赤色に変化します。この色の変化を指示薬の変色の代わりに利用して滴定を行うのが過マンガン酸滴定です。
滴定には、中和滴定と同じようにビュレット・コニカルビーカーを用い、操作もほとんど同じですが、例題に入る前に、理論について説明しておきますね。
濃度のわかっている過マンガン酸カリウム水溶液を用いて、濃度のわからないH2O2 水溶液の濃度を調べる方法を考えます。
試料の調製方法を含む実験方法は中和滴定と同じですので説明は省き、当量点までに必要なKMnO4標準水溶液の体積を求めてからの計算方法について説明します。
過マンガン酸滴定
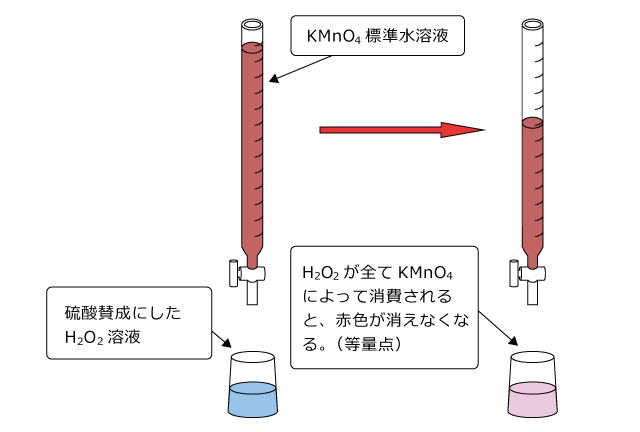
濃度不明の H2O2 水溶液 v1mℓ を濃度 c mol/ℓの KMnO4 水溶液で滴定したところ、当量点までの滴下量が v2mℓ だったとして、H2O2 水溶液の濃度を求めてみましょう。
H2O2 水溶液の濃度を χ mol/ℓ と置きます。
まず KMnO4 と H2O2 が何対何の割合で反応するのかを調べるために、半反応式を書きましょう。
| 過マンガン酸イオン | : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O |
|---|---|
| 過酸化水素 | : H2O2 → O2 + 2H+ + 2e- |
この反応式を見ると、過マンガン酸イオン 1mol が反応するのにe-は 5mol 必要で、過酸化水素 1mol が反応すると、e- は 2mol 必要であることが分かります。
酸化還元反応では酸化剤が受け取る電子の物質量と、還元剤が放出する電子の物質量が等しくなりますから、KMnO4 : H2O2 = 2:5 の割合で反応するはずですね。
反応した KMnO4 は、 c1 × ![]() mol
mol
反応した H2O2 は、 χ × ![]() mol
mol
従って、 KMnO4 : H2O2 = 2 : 5 = c × ![]() : χ ×
: χ × ![]() が成立します。
が成立します。
これを解いて、χ = ![]() mol/ℓ
mol/ℓ
ポイントは、半反応式を書いて、酸化剤 1mol が受け取る e- と還元剤 1mol が放出する e- の物質量の値から、酸化剤と還元剤が 何mol 対 何mol の比率で反応するかを考える事です。





















































