理論化学
第23回:酸化と還元⑤
COD測定の例題
(例題)
1ℓ の河川水を採取し、硝酸銀を加えて生じた沈殿をろ過した後、濃硫酸とc1 mol/ℓの過マンガン酸カリウム水溶液をv 1 mℓ 加えて加熱する。
ここに、c2 mol/ℓ のシュウ酸水溶液をv2 mℓ加えると、溶液の色が無色となった。
ビュレットにc3 mol/ℓ の過マンガン酸カリウムを入れ、v3 mℓ を滴下すると溶液の色が薄い赤色となり、振り混ぜても色が消えなくなった。この河川水のCOD ( mg/ ℓ ) を計算せよ。
(解説・解答)
最初に加えた過マンガン酸カリウムの物質量は c1 × 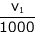 mol ですね。この一部が有機物と反応して、有機物を酸化したわけです。
mol ですね。この一部が有機物と反応して、有機物を酸化したわけです。
次に、加えたシュウ酸の物質量は c2 × 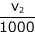 mol です。最初に加えた過マンガン酸カリウムの余りがこのシュウ酸と完全に反応して、更に余ったシュウ酸を滴定するのに必要な過マンガン酸カリウムが c3 ×
mol です。最初に加えた過マンガン酸カリウムの余りがこのシュウ酸と完全に反応して、更に余ったシュウ酸を滴定するのに必要な過マンガン酸カリウムが c3 ×  mol 必要ということですね。
mol 必要ということですね。
ちょっとややこしいですが、まとめると
加えた過マンガン酸イオンの物質量は全部で c1 × 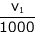 + c3 ×
+ c3 ×  mol
mol
シュウ酸イオンの物質量は全部で c2 × 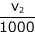 mol
mol
そして、過マンガン酸イオンのうち、シュウ酸イオンと反応しなかったものが水中の有機物と反応したのですが、その量を、過マンガン酸イオンとシュウ酸イオンの半反応式から求めましょう。
半反応式より、過マンガン酸イオンとシュウ酸イオンは 2:5 の割合で反応します。したがって、有機物と反応した過マンガン酸イオンの物質量は、以下の式で表せます。

最後に、過マンガン酸イオンの物質量を酸素の質量に変換します。まず、次の半反応式より、1mol の過マンガン酸イオンは、![]() molの酸素に相当しますね。
molの酸素に相当しますね。
| 過マンガン酸イオン | : MnO4- | + 8H+ | + 5e- | → Mn2+ | + 4H2O |
| 酸素 | : O2 | + 4H+ | + 4e- | → 2H2O | |
したがって、1ℓの河川水中の有機物を酸化するのに必要な酸素の物質量は
( c1 × 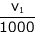 + c3 ×
+ c3 ×  - c2 ×
- c2 × 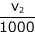 ×
× ![]() ) ×
) × ![]() mol
mol
酸素の分子量は32ですから、1ℓ の河川水中の有機物を酸化するのに必要な酸素の質量、すなわち、この河川水のCOD は
( c1 × 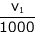 + c3 ×
+ c3 ×  - c2 ×
- c2 × 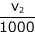 ×
× ![]() ) ×
) × ![]() × 32 × 103 mg/ℓ
× 32 × 103 mg/ℓ
CODの測定は、私大医学部の入試でも頻出の事項ですね。手順はやや複雑ですが、覚えてしまえば10回出題されたら10 回とも解くことができるような問題ですから、しっかりとマスターしておきましょう。
それでは、今回はここまでにします。お疲れ様でした。





















































