理論化学
化学講座 第25回:電池①(ボルタの電池とダニエル電池)
ダニエル電池 (Zn | ZnSO4 aq | CuSO4 aq | Cu )
ボルタの電池の弱点は、正極にH2が生じることによる分極でした。そこで、H2 が発生しないように電解液を CuSO4 に変更してみます。そうすると、H+ の代わりに Cu2+ が電子を受け取りますから、Cu 極板上で次の反応が起こって銅が析出します。

すると、正極の銅板の上に銅が析出する事になりますから、これなら分極は起こらないはずです。
電解液を CuSO4 水溶液にしたボルタの電池
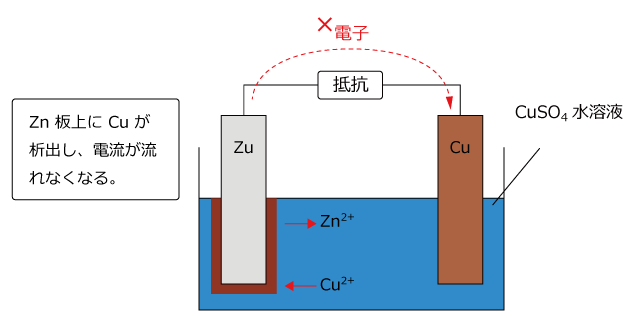
しかし、実際にやってみると、Cu はZn よりもイオン化傾向が小さいので、Zn 板上で次の反応が起こり、Zn 板上にもCu が析出してしまいます。つまりZn 板がCuでメッキされてしまいます。これでは電池としては全く機能しません。

そこで、Zn 板とCu 板の間に素焼き板を入れて Zn 板の方には ZnSO4 水溶液を、Cu 板の方にはCuSO4 水溶液を入れます。
すると、Zn 板とCu 板のそれぞれで次のような反応が起こって電流が流れます。
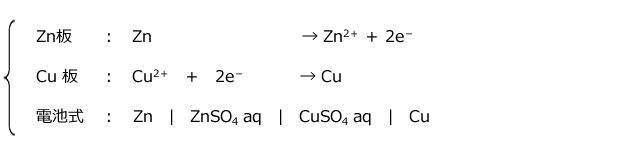
電解液は、素焼き板で仕切られていますから、一見、電流が流れないように思われますが、素焼き板は小さな穴がたくさんあいていますので、イオンが通過する事ができます。ZnSO4 水溶液側から CuSO4 水溶液側に向かって Zn2+ が、CuSO4 水溶液側から ZnSO4 水溶液側に向かってSO42-が移動する事によって回路が完成します。
ダニエル電池

この電池はダニエル電池と言い、一時期、実用電池として大学などで使用されていました。起電力はボルタ電池と同じ 1.1V です。
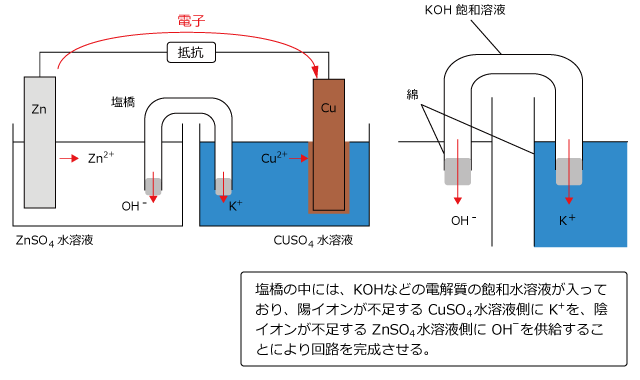
素焼き板は、正極側と負極側の電解液が混合しないように分離し、かつ、陽イオンと陰イオンを通過させるためのものですが、この作用を徹底したものが塩橋です。
塩橋は、KOH や KCl などの電解質を多量に含むゼラチンをU字管に入れ、綿やろ紙などでふたをしたものです。これを使って完全に分離した正極と負極の電解液を下図のように橋渡しします。
電池の放電が起こると、負極の ZnSO4 水溶液では Zn2+ の濃度が上昇し、正極の CuSO4 水溶液では Cu2+ の濃度が減少します。そのため、負極側は正に帯電し、正極側は負に帯電してしまい、すぐに電流が流れなくなってしまいます。
塩橋があると、負極側に陰イオンの OH- を、正極側に陽イオンの K+ を供給するため、帯電が解消され、電流が流れ続けます。
塩橋を用いたダニエル電池
さて、今回はボルタの電池とダニエル電池という、最も基本的な電池を解説しました。次回は実用電池の燃料電池や鉛蓄電池について解説しようと思います。
それでは、また。





















































