理論化学
化学講座 第27回:電気分解【電気分解のルールと銅の電解製錬】
電池などの外部電源(以下電源)から電流を供給する事により、酸化還元反応を用いて CuCl2 のような電解質をその構成単体に分解する事(つまり、陽イオンに電子を与えて単体にしたり、陰イオンから電子を受け取って単体にすること。)を電気分解といいます。
例えば、CuCl2 の水溶液に白金電極を入れて電源に接続すると、電源の正極側に接続された極板は電子が不足するため、正に帯電します。
そうすると、水溶液中の Cl- が正に帯電した極板に引き寄せられてきます。そして、 Cl- が極板と接触すると、 Cl- は電子を極板に渡し、自身は Cl2 になってしまいます。この反応は電子を奪われる反応なので、酸化反応です。
一方、外部電源の負極側に接続された極板は、電子が流れ込んだため負に帯電し、Cu2+ が引き寄せられてきます。Cu2+ が極板に接触すると、Cu2+ は極板から電子を受け取り、Cu となって極板上に析出します。
極板の上に Cu がメッキきされるわけです。この反応は電子を与えられる反応なので、還元反応です。
このように、電気分解では外部電源の正極につながれた極板(これを陽極と言います)で酸化反応が、外部電源の負極につながれた極板(これを陰極と言います)で還元反応が起こり、電解質が分解されるのです。
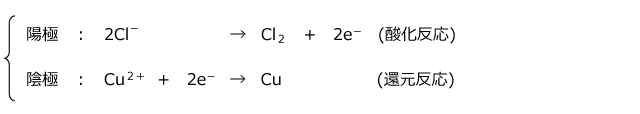
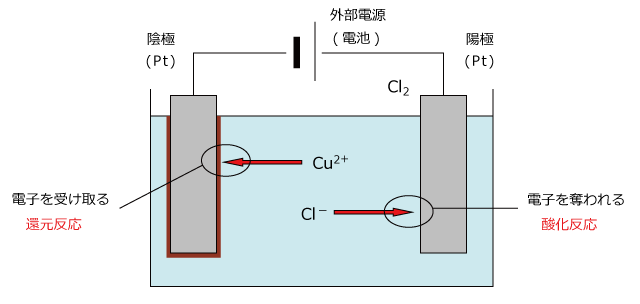
このように、陰極で陽イオン、陽極で陰イオンがそれぞれ電子を授受して反応するのですが、実は、反応しないイオンもあります。
例えば、アルカリ金属やアルカリ土類金属の陽イオンはイオン化傾向が非常に大きく、陽イオンが安定なため電子を受け取らず、普通の電気分解では反応しません。陰イオンでは SO42- や NO3- や CO32- のような多原子イオンは反応しません。これは、多原子イオンの酸素以外の酸化数は最大値となっていて、それ以上酸化することができないからです。(それ以上電子をあげることができない。)

一方、陽極板が溶解する場合があります。陽極板からは電子がどんどん吸い取られていっているのですが、極板がPt、C、Au以外の場合、極板そのものが電子を奪われてしまい、陽イオンとして溶け出していきます。Pt、C、Au はイオン化傾向が小さすぎて電子を奪えないので溶けないのです。
このように、陽極や陰極で反応するイオンがない場合には、イオンや極板の代わりに水が反応します。陽極で水が反応する場合は酸素が、陰極で反応する場合は水素が発生します。
注意してほしいのは、塩基性のときは陽極で OH- が反応し、酸性のときは陰極で H+ が反応し、それ以外の場合は H2O が反応するという事です。
水の反応
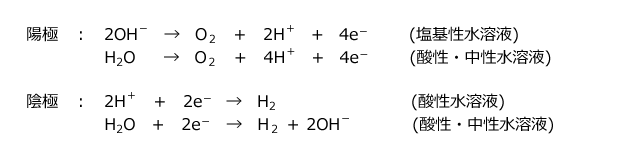
これらのことをふまえて、電気分解において各極板で起こる反応をルール化すると次ページのようになります。