理論化学
化学講座 第36回:理想気体の状態方程式
複雑な現象を科学的に捉えるためには、モデル化が必要です。
モデル化というのは、本質をとらえるためにわざと単純化することで、実際とは異なるのだけど、大切な特徴だけをとり出した架空のものを考察することによって、複雑な事象を捉えようとするものです。
高校化学では、気体の圧力、体積、温度、物質量のあいだにある関係を状態方程式として習いますが、その際、理想気体というモデルで考えます。
実際の分子は大きさを持っており、分子間には種類によって大小様々な分子間力が働いています。このため、分子は周囲にある分子から常に影響を受けており、その影響のために凝縮、昇華と言った状態変化をします。気体についての知識が十分でなかった時代に、このような複雑な事象を数式的に取り扱うことは無理でした。
そこで、気体分子の大きさを考えず、分子間に働く一切の相互作用を無視したモデルを考えることにしたのです。このような架空の気体が、理想気体です。
- 理想気体:
- 分子間力は働かない
分子そのものに体積はない - ⇒気体分子は独立に動くので、1 分子に着目してその動きを解析すれば、全体の挙動をとらえることができる。また、状態変化を考えなくてよい。
- 実在気体:
- 分子間力は働く
- 分子そのものに体積がある
- ⇒他の気体分子から受ける影響を考慮する必要がある。また、状態変化を考える必要がある。
このように仮定された気体、理想気体の圧力、体積、温度、物質量のあいだにある関係を、ある容器の中に封入した分子の挙動から考えていくことにします。考えなくてはいけないパラメーターが 4 つもありますので、その中から 1つ選んで、圧力に着目し、これが他のパラメーターとどういう関係にあるのかを考えることにします。
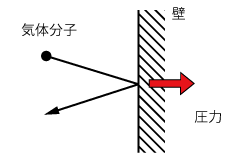
まず、気体の圧力とは何かを考えてみましょう。
気体分子は自由に空間を運動しています。そして、ある分子は容器の壁に衝突して跳ね返されます。
このとき、容器は気体分子にわずかに押されることになりますが、この力を合計したものが気体の圧力なのです。
次に、気体の物質量や体積、温度がどのように影響するかを考えてみましょう。
① 気体の物質量 (n mol)
気体の物質量が大きいほど壁にぶつかる分子の数は当然多くなります。同じ体積の気体であれば、そこに含まれる物質量が 2 倍になれば、単位時間あたりに壁にぶつかる分子の数は 2 倍になりますから、圧力は 2 倍になりますね。
物質量が 3 倍なら圧力も 3 倍です。
という事で、気体の圧力は、物質量に比例します。
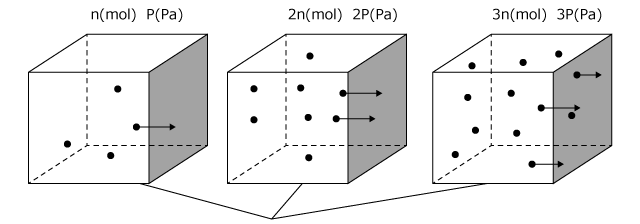
気体分子の数が m 倍になると、単位時間あたりに壁にぶつかる分子の数は m 倍になり、圧力も m 倍になる。
⇒気体の圧力 P (Pa) は気体の物質量 n (mol) に比例する。
② 気体の温度 T (K)
分子は常に運動をしています。これを熱運動というのですが、熱運動は温度が高くなればなるほど激しくなります。逆に、熱運動の激しさを表すのが温度なのです。
さて、圧力は温度が高いほど大きくなります。というのも、温度が高いほど分子の熱運動がはげしいのですから、分子が壁にぶつかった時に壁におよぼす力も大きくなります。従って気体の圧力は温度が高いほど大きくなるのです。
気体の圧力は気体の絶対温度T(K)に比例します。なぜ比例するのかは化学の範囲 ではなく物理の範囲になるので省略します。
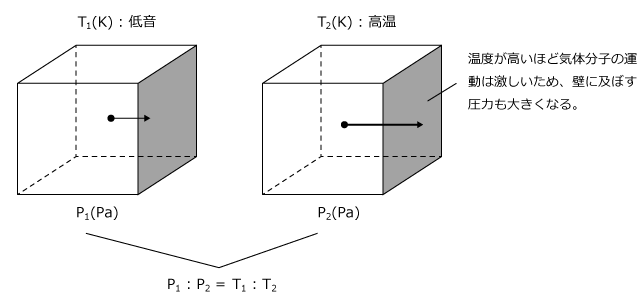
⇒気体の圧力 P (Pa) は気体の温度 T (K) に比例する。
③ 気体の体積 V (L)
気体分子は、たえず運動していますから、一度壁にぶつかって跳ね返された後、またどこかではねかえって同じ壁にぶつかります。この頻度が大きいほど、つまり、一度ぶつかってからどこかではねかえって戻ってくるまでの時間が短いほど圧力は高くなります。
なぜ反比例になるのかは化学の範囲ではなく物理の範囲ですので省略します。分子が壁に衝突する頻度は体積に反比例します。従って、圧力も体積に反比例するのです。
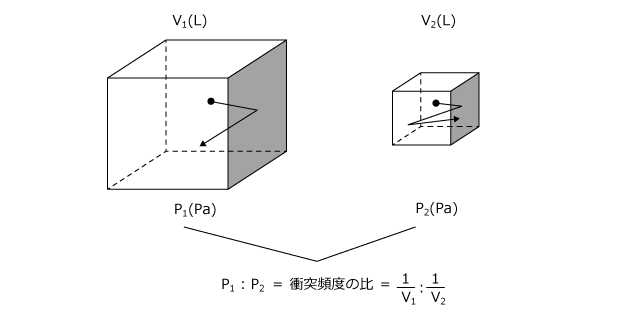
⇒気体の圧力 P (Pa) は気体の体積 V (L) に反比例する。
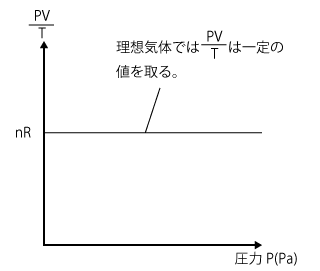
① ~ ③ から、気体の圧力 P (Pa) は、物質量 n (mol) と絶対温度 T (K) に比例して、気体の体積 V (L) に反比例することが分かりました。そこで、比例定数を R と置くと、圧力 P (Pa) は次のように表すことができます。
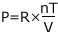 これを整理すると、PV=nRT となります。これが理想気体の状態方程式なんです。
これを整理すると、PV=nRT となります。これが理想気体の状態方程式なんです。
このような関係式を見た時には、単に暗記するだけではなく、意味を考えることが大切です。
例えば、理想気体の状態方程式を体積 V (L) について解いてみると 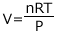 となりますから、気体の体積は圧力が 2 倍になると
となりますから、気体の体積は圧力が 2 倍になると![]() 倍になるし、温度が 2 倍になると 2 倍になる。物質量が 2 倍になった時も同じように 2 倍になる。ということが分かりますね。こうやって、式の意味を考えるのがとても大切なのです。
倍になるし、温度が 2 倍になると 2 倍になる。物質量が 2 倍になった時も同じように 2 倍になる。ということが分かりますね。こうやって、式の意味を考えるのがとても大切なのです。
この練習をちょっとしてみましょう。理想気体の状態方程式からボイルの法則やシャルルの法則を導いてみます。
① ボイルの法則
理想気体の状態方程式は、気体の温度、体積、物質量、圧力の関係式でした。ここで、物質量と温度を一定にしたとき、残りの体積と圧力はどういう関係にあるかを考えてみましょう。
理想気体の状態方程式は、PV = nRT ですね。ちょうど、n と T を一定にするわけですから、左辺に変数の P とV があって、右辺は定数になっていますね。ということは、PV=(一定値) ということになりますから、PとVは反比例の関係になる事が分かります。
ですから、n と T を一定にして P と V の関係をグラフにすると、下図のようになります。
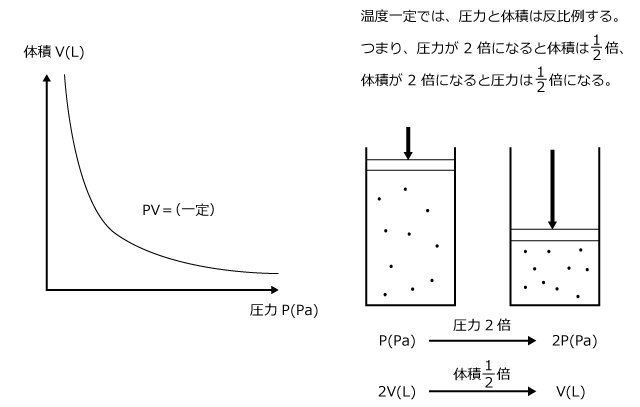
どうでしょう、理想気体の状態方程式考察することによって、物質量 n (mol) と温度 T (K) が一定なら、PV の値が一定になる事が分かりましたね。
もうわかってると思いますが、これがボイルの法則なのです。なんと、ボイルの法則は n と T が一定の時の状態方程式だったのです。なんか、これって新鮮じゃないですか?
このように、与えられた関係式を着目する値について解いてみたり、あるいは今回のように左辺に変数を集めると、それらの間にある関係がはっきり見えてくるのです。
もう少し詳しく見てみましょう。今度は、PとVの関係ではなくて、比例定数の部分について考えてみます。
PV=nRT をじっと見ていると、PとVが反比例の関係にあるという事のほかに、その比例定数がnとTに比例している事が分かりますね。( nRT の部分です。)
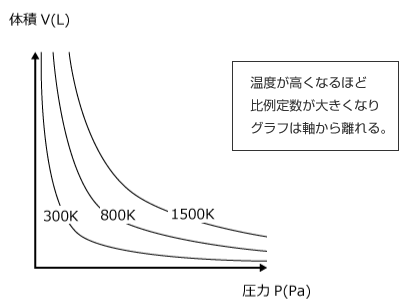
ここからわかることは、n や T を大きくするほど比例定数が大きくなり、P と V の関係を表すグラフは軸から離れるという事です。
ためしに n を一定にして300 K、800 K、1500 Kでのグラフを描いてみると右図のようになります。
当然、n を大きくしても同じようにグラフは軸から離れていきます。
これは後で(飽和蒸気圧の後のあたり)でも出てきますので、注意してくださいね。
② シャルルの法則
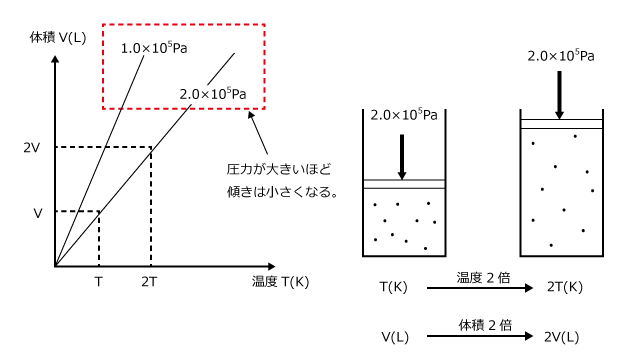
では、次は P (圧力) を一定にして V と T を変化させてみましょう。ボイルの法則でやったのと同じように、左辺に変数、右辺に定数を集めます。
理想気体の状態方程式 PV=nRT より 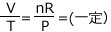 となりますね。比例の式はこうして見ると分かりずらいので、Vについて解いてみると、
となりますね。比例の式はこうして見ると分かりずらいので、Vについて解いてみると、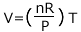 となります。n が一定なら、P が小さいほど比例定数が大きい、つまり傾きが大きなグラフになる事が分かりますね。
となります。n が一定なら、P が小さいほど比例定数が大きい、つまり傾きが大きなグラフになる事が分かりますね。
③ ボイル・シャルルの法則
最後に、P、T、V を自由に動かしてみましょう。
一定になっているのはn ( 物質量 ) だけですから、PV=nRT より 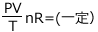 となりますね。
となりますね。
気体の量が一定であれば、![]() という値が常に 一定になっている。というのも面白い話ですよね。
という値が常に 一定になっている。というのも面白い話ですよね。
さて、今回の授業はここでおしまいです。結果を覚えるだけではなく、その成り立ちを知ることで応用の範囲が広がる。というのが分かってもらえたと思います。第 2 回は分圧の法則について説明します。お楽しみに。





















































