理論化学
化学講座 第41回:Z-P曲線とファンデルワールスの式
実在気体と理想のちがいをつくる要因
実在気体と理想気体の差を表す指標に、圧縮率因子というのがあります。
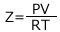 で表される値なのですが、よく見てみると、理想気体の状態方程式の物質量と同じ形をしています。ですから、理想気体では Z の値は圧力や温度を変えても常に一定の値を取ります。
で表される値なのですが、よく見てみると、理想気体の状態方程式の物質量と同じ形をしています。ですから、理想気体では Z の値は圧力や温度を変えても常に一定の値を取ります。
一方、実在気体では、気体分子の体積や分子間に働く分子間力の影響で Z の値は一定値からずれてしまいます。そのずれの大きさを見れば、その実在気体が理想気体からどれくらいずれているかということが分かります。
Zの意味は後で考えることとしてまず、実在気体と理想気体のちがいをつくる範囲を考えてみましょう。理想気体と実在気体のちがいは、分子間力が働くこと、分子の体積が無視できない事でした。
この違いのうち、分子間力は気体の体積を小さくする効果があります。同じ温度、同じ圧力の時、分子間力が働く実在気体では、気体同士がひきつけあうため、気体全体の体積が理想気体より小さくなってしまうのです。
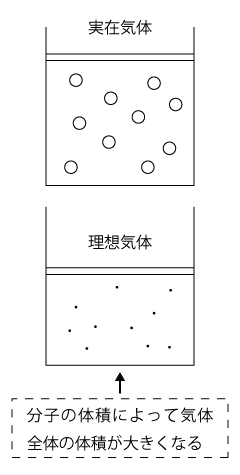
また、気体分子の体積は気体の体積を大きくする効果があります。同じ温度、同じ圧力のとき、分子の大きさの分だけ、気体全体の体積は理想気体より実在気体の方が大きくなってしまうのです。
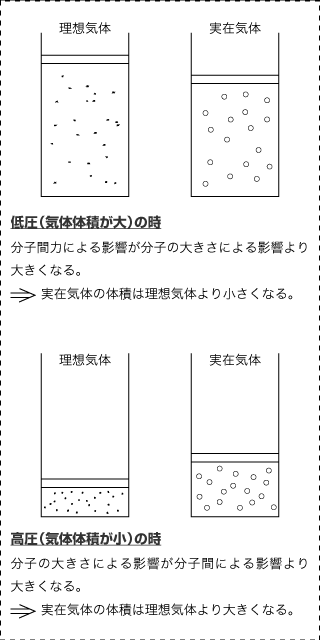
正反対の影響を及ぼすこの二つの要因のどちらが強く働くかは、気体の圧力や体積、そして温度などによって決まります。まず、同じ温度での気体の圧力(体積)に着目してみましょう。
低圧(体積が大)の場合、右図のようなイメージをしてもらえばわかると思いますが、気体分子そのものの大きさは問題にはなりません。
広いスペースに小さな分子が分散しているので、分子の大きさは無視できます。しかし、分子間力は働くので、実在気体は理想気体より体積が小さくなります。
高圧(体積が小)の場合は、スペースのせまいところにぎゅうぎゅう詰めになっているので分子の体積が無視できなくなりなす。お互いに衝突しあいその分、気体全体の体積が大きくなります、即ち、実在気体は理想気体より体積が大きくなります。
Z-P曲線
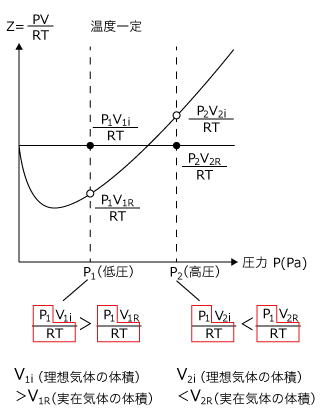
一定温度で実在気体の Z の値を、横軸に P を取ってグラフを描くと、下図のようになります。
比較的圧力の小さい場所では理想気体より小さく、圧力の大きいところでは理想気体より大きくなっています。
これが何を意味しているのか考えてみましょう。Zを決める値は、TとPとVの3つです。このうちTは一定ですが、PとVは変数です。2 変数では良く分かりませんので、Pを固定して考えることにしましょう。
まず、低圧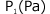 に着目します。
に着目します。
そうすると、Zの値は理想気体より実在気体の方が小さくなっていますね。
これは何を表しているのでしょうか。
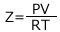 ですから、TとPを固定すると、Zの値はVのみによって決まります。従って、Zが小さいということは体積が小さいことを表しています。
ですから、TとPを固定すると、Zの値はVのみによって決まります。従って、Zが小さいということは体積が小さいことを表しています。
高圧の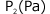 では逆に、Zの値は実在気体の方が大きくなっていますね。
では逆に、Zの値は実在気体の方が大きくなっていますね。
つまり、高圧では実在気体の方が体積が大きいことが分かります。
これらの結果は先ほど考察した結果と一致していますね。
実在気体を理想気体に近づける条件
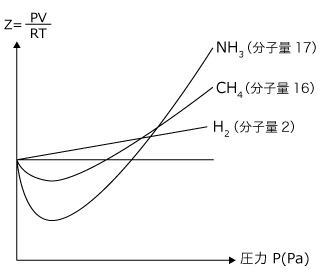
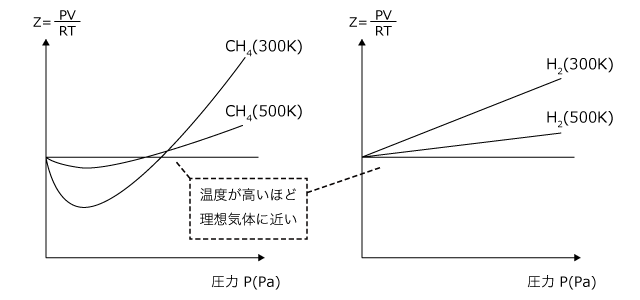
次に、気体の種類による影響を考えましょう。実在気体と理想気体の差は、気体の体積と分子間力によるものなので、これらが大きいものほど理想気体から大きくずれます。
では、それはどのような気体かというと、分子量が大きくて極性のある気体です。
分子間力は分子量が大きくて極性の大きなものほど大きいですし、体積は分子量の大きいものほど大きくなるのは当然ですよね。実際、![]() (分子量17、極性あり)、
(分子量17、極性あり)、![]() (分子量16。極性なし)、
(分子量16。極性なし)、![]() (分子量2、極性なし)のZ-P曲線は上図のようになります。
(分子量2、極性なし)のZ-P曲線は上図のようになります。![]() が最も大きくずれていて、
が最も大きくずれていて、![]() が最もずれていないことがわかりますね。
が最もずれていないことがわかりますね。
次に、温度に対する変化を考えてみましょう。同じ圧力で温度が大きいとどうなるでしょうか。気体の状態方程式に従うのであれば、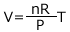 ですから、温度が高いほどVは大きくなります。体積が大きいほど気体分子そのものの大きさの影響は小さくなりますから、温度が高いほど理想気体に近づきます。
ですから、温度が高いほどVは大きくなります。体積が大きいほど気体分子そのものの大きさの影響は小さくなりますから、温度が高いほど理想気体に近づきます。
また、温度が高くなって分子の運動が激しくなると、分子間力による影響も小さくなります。感覚的ですが、ものすごく速く動いている物体に少々の力を加えてもその運動はなかなか変化しないけれど、ゆっくり動いている物体には少し力を加えるだけで運動を変化させられる。というくらいで理解しておけば大丈夫です。
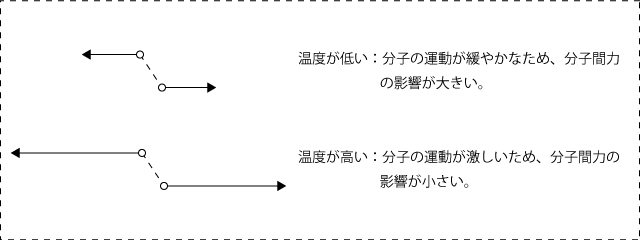
温度を変えてZ-P曲線を描くと下図のようになります。温度が高くなるほど理想気体に近づくことがわかりますね。
以上の事から、理想気体に近い実在気体というのは、圧力が低く(体積が大きく)、温度が高く、分子量が小さくて極性がない気体です。
ファンデルワールスの式
理想気体の状態方程式を理想気体に応用する方法を考えてみます。これは、一応高校の範囲外ですが、大学受験には出題されるため、知っていた方がいいでしょう。
まず、理想気体の状態方程式はPV=nRTで表されるのでした。ここで、n、Rは定数。Tは実在気体でも理想気体でも変わりませんから、右辺には何も補正をする必要はなさそうです。
1)Pに対する補正
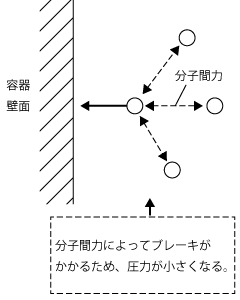
Pに対する補正を考えましょう。実在気体は分子間に分子間力が働いています。そのため、壁に衝突しようとするとき、周りの分子から分子間力によるブレーキを掛けられて、その分、圧力は理想気体より小さくなります。この大きさは![]() (aは気体の種類による定数)と表せます。
(aは気体の種類による定数)と表せます。
従って、実在気体の圧力が![]() だとすると、これが理想気体だった場合の圧力は
だとすると、これが理想気体だった場合の圧力は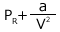 と表すことができます。
と表すことができます。
(実在気体の方が圧力が小さいので、その分を加えればいいのです。)
2)Vに対する補正
Vに対する補正を考えましょう。実在気体は分子の体積の分だけ体積が大きくなっています。この大きさはb(bは気体の種類による定数)と表すことができます。
従って、実在気体の体積を![]() だとすると、これが理想気体だった場合の体積は、
だとすると、これが理想気体だった場合の体積は、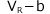 と表すことができます。
と表すことができます。
(実在気体の方が体積が大きいので、その分を引けばよいのです。)
この補正を行うと、理想気体の状態方程式は、次のように書くことができます。
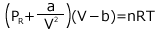
この式をファンデルワールスの式と言います。





















































