理論化学
化学講座 第51回:化学反応速度② 素反応の反応速度式
前回は、化学反応速度の定義やグラフの見かたについて説明をしました。しかし、前回の方法では瞬間の反応速度はグラフの関数が分からないと、接線を求めることできませんでした (データから近似法を用いてグラフの式を求め、その式を微分して接線を求める方法がありますが、高校では出題されません。) 。今回は、グラフを使わずに瞬間の化学反応速度を求めることを考えます。
化学反応の速度を考えるには、まず、化学反応のメカニズムについて知っておく必要がありそうですね。だって、それを知らないと、何が化学反応の速度の決め手になるかわからないですから。以下では、反応のメカニズムを説明しながら、化学反応式がどのような要因で決まるかについて説明していこうと思います。
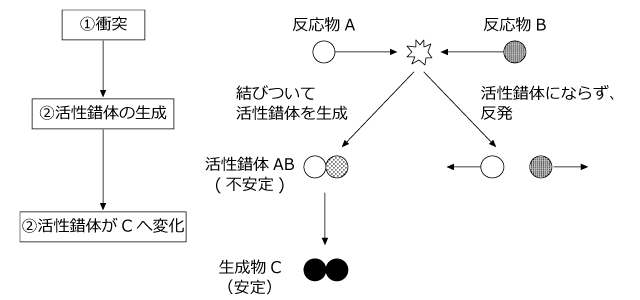
モデルとして、A + B → C という反応を考えます。反応のメカニズムは3段階で、① 反応物 A と B が衝突 ② 衝突したものの一部が活性錯体となる (反応中間体が生成) ③ 活性錯体が生成物 C へ変化 です。
活性錯体、というのがぴんと来ないかもしれませんが、簡単に言うと、中途半端に反応した状態の事です。生成物の C になりかかってるんだけど、まだ完全になりきってない。そんな中途半端な状態なんです。
これはとても不安定で、すぐに生成物の C に変化してしまうのです。
不安定というのは、ポテンシャルエネルギーをたくさん持った状態の事です。ポテンシャルエネルギーというのは、エネルギーの貯金みたいなものです。ここは詳しく説明するととても長くなってしまうので、他の回で説明しようと思います。
では、この3つの段階がどのように反応速度に影響するか考えてみましょう。
①衝突
化学反応の第一段階は、反応物同士が衝突する事です。ぶつからない事には反応が始まりませんね。
単位時間に衝突が起こる回数 (衝突頻度) が多ければ多いほど反応速度が大きくなります。反応物 A の1分子に着目してみましょう。 A は熱運動で動き回っていますが、単位時間に下図の塗りつぶし部分を通過するとします。
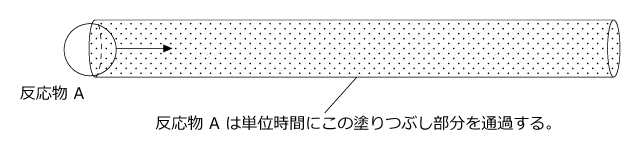
そうすると、この反応物 A は塗りつぶし部分にある反応物 B と衝突することになります。
ですから、B の濃度が2倍になると衝突回数も2倍、3倍になると3倍になります。
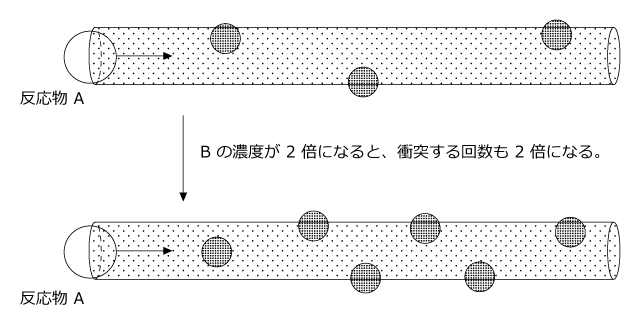
反応物 A についても同じことが言えますので、衝突頻度は A の濃度と B の濃度の両方に比例することが分かります。
そして、反応速度は衝突頻度に比例しますから反応速度は A の濃度に比例し、かつ、B の濃度にも比例することになります。
ですから、反応速度 v ∝ [A] [B] と書くことができますね。
さて、反応が A + B + C → D ならどうでしょうか。
この場合は A、B、C のそれぞれに比例しますから、反応速度 v ∝ [A] [B] [C] となります。
では、反応が 2A + B → C ならどうでしょうか。
この場合は、反応式を A + A + B → C と書くことができますね。
従って、反応速度 v ∝ [A] [A] [B] = [A]2 [B] となります。
mA + nB → C でも同じことですね。
以上から、mA + nB → C の反応速度を v とすると、v ∝ [A]m [B]n が成立します。
②活性錯体の生成
第二段階は活性錯体の生成です。活性錯体というのは反応の途中で生じる不安定な中間体です。ある程度以上の運動エネルギーをもった状態で反応物が衝突すると、活性錯体が生じます。運動エネルギーが足りないと活性錯体にならずにはねかえってしまいます。
これは、分子や原子の周りには多数の電子があるために、電気的な反発力が生じているからです。その反発力に逆らってくっつくためには、ある程度の勢いでぶつからないといけないのです。
くっついて活性錯体になるために必要な最低限の運動エネルギーの事を活性化エネルギーと言います。
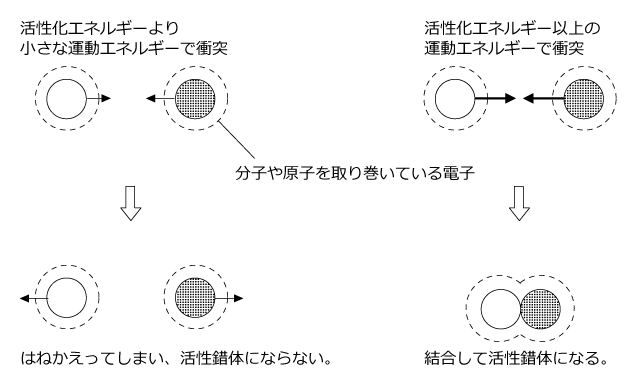
衝突しても活性化エネルギー以上のエネルギーを持っていないと反応が起こらないのです。従って、運動エネルギーが大きな分子の割合が多いほど衝突した時に反応が起こる可能性が大きく、反応速度は大きくなります。
では、運動エネルギーが大きいとはどういう事でしょうか。
分子は熱運動をしているという話を以前しましたね。そして、高温ほど熱運動が激しいという事も説明しました。
つまり、温度が高いほど、分子の持っている運動エネルギーは大きくなるのです。ですから、温度が高いほど反応速度は大きくなります。10(K) 高いと、反応速度は2~3倍になります。結構出題されるので覚えておきましょう。
以前紹介しましたが、運動エネルギーと分子数の分布は下図のような曲線になる事が知られています。
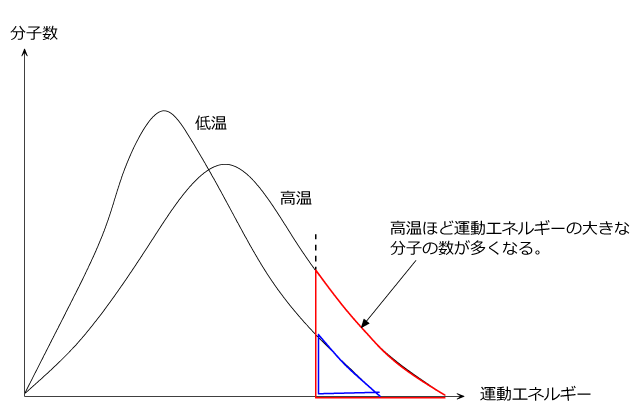
温度が高いほど大きな運動エネルギーを持っている分子が多いことが分かりますね。
③生成物の生成
活性錯体は非常に不安定なので、すぐに安定な生成物になります。このとき、余ったエネルギーが熱として放出されます。
③ の反応は非常に速く、活性錯体 AB が生じるとすぐに C になってしまうので、反応速度に影響を与えないと考えます (大学ではこの部分の速度も考えます)。ですので、反応速度に影響を与えるのは①と②ということになります。(こうやって、反応速度に影響を与える段階の事を、律速段階と言います。)
以上の事から、mA + nB → C で表される化学反応の反応速度式は
v = k [A]m [B]n と表すことができます。
k は反応速度定数と言い、温度と活性化エネルギーで決まる値です。
温度が 10(K) 上昇すると反応速度が2~3倍になると言いましたが、温度が上がるとこの k の値が大きくなります。
※このような形で反応速度を表すことができる反応は、「素反応」と呼ばれるものだけで、種類が相当限られています。化学の問題で、反応速度の問題って、H2 + I2 ⇔ 2HI や N2 + 3H2 ⇔ 2NH3 など、反応の種類が限られていますね。これは、ほとんどの反応が素反応ではないため、この形で反応速度を表すことができないからです。
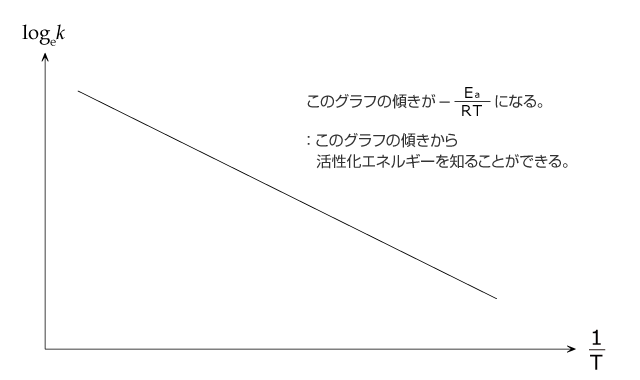
反応速度定数と温度 T(K) の関係を表す式をアレニウスの式と言います。昔はあまり出題されませんでしたが、最近は時々出題されていますので、説明しておこうと思います。
アレニウスの式は次のような形をしています。
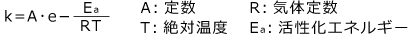
このままではよくわからないので、両辺の自然対数 loge を取ってみましょう。
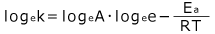
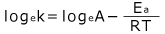
整理すると、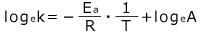 となります。
となります。
反応が決まっていれば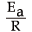 や A は定数ですから loge k と
や A は定数ですから loge k と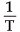 が比例関係にあることが分かります。そして、この二つの値を測定してグラフにすると下図のような直線が得られ、このグラフの傾きから Ea :活性化エネルギーを求めることができるのです。
が比例関係にあることが分かります。そして、この二つの値を測定してグラフにすると下図のような直線が得られ、このグラフの傾きから Ea :活性化エネルギーを求めることができるのです。