理論化学
化学講座 第54回:化学反応速度⑤ 化学平衡
可逆反応と化学平衡
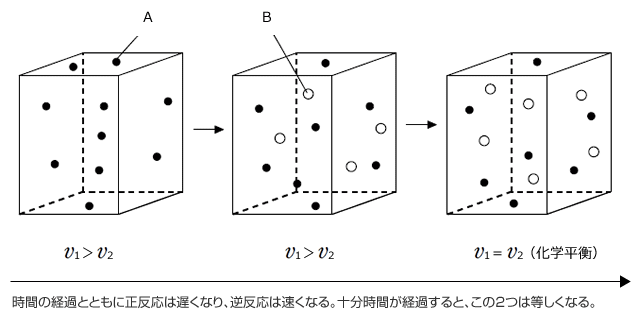
逆反応がおこる反応を可逆反応と言います。可逆反応は反応開始から十分に時間がたつと正反応(右向きの反応)と逆反応(左向きの反応)の速度が同じになって、反応物も生成物も濃度が変化しない状態になります。このように、反応はおこっているが、正反応と逆反応の速度が等しくなり、見かけ上反応がおこっていないように見える状態を化学平衡といいます。
化学平衡に達するまでのA![]() 2Bという可逆反応を例として、反応物Aのみを反応容器に入れて反応させた場合の濃度と反応速度の変化について説明します。
2Bという可逆反応を例として、反応物Aのみを反応容器に入れて反応させた場合の濃度と反応速度の変化について説明します。
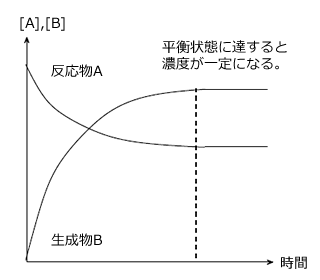
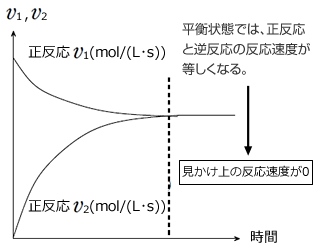
反応物AはA→2Bで表わされる正反応により徐々に減少していきます。 しかし、Aが減少してBが生成すると、2B→Aで表わされる逆反応が起こり、BからAが生じるため、全てのAがなくなってしまう事はなく、十分に時間が経過するとAの濃度は一定になります。
一方、生成物Bは、最初は反応物Aが多いため、急激に増加しますが、時間の経過とともにAが減少して正反応の反応速度が小さくなること。Bが増加すると逆反応2B→AがおこってBが消費されることから、Bの増加は時間とともにゆっくりになり、十分に時間が経過するとBの濃度は一定になります。
ここまでの説明を反応速度式をもとに解説します。
正反応の反応速度は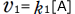 と表わされますから、反応によりAの濃度([A])が小さくなると正反応の反応速度は小さくなります。
と表わされますから、反応によりAの濃度([A])が小さくなると正反応の反応速度は小さくなります。
一方、逆反応の反応速度は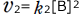 と表わされるので、反応によりBの濃度([B])が大きくなると逆反応の反応速度は大きくなります。
と表わされるので、反応によりBの濃度([B])が大きくなると逆反応の反応速度は大きくなります。
そして、右図のように、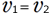 となると、見かけ上、反応がおこらなくなったように見えます。(反応物も生成物も濃度変化が起こらなくなる)、これを化学平衡といいます。
となると、見かけ上、反応がおこらなくなったように見えます。(反応物も生成物も濃度変化が起こらなくなる)、これを化学平衡といいます。
質量作用の法則、濃度平衡定数
化学平衡になっている時の各成分の濃度の間に成立する関係を、質量作用の法則と言います。
質量作用の法則はこれ以降、化学平衡関係の問題では常に出てくる式で、ものすごく重要です。
aA+bB![]() cC+dDを例として説明します。この可逆反応で化学平衡が成立しており、正反応の反応速度定数を
cC+dDを例として説明します。この可逆反応で化学平衡が成立しており、正反応の反応速度定数を![]() 、逆反応の反応速度定数を
、逆反応の反応速度定数を![]() とします。すると、次の3式が成立します。
とします。すると、次の3式が成立します。
正反応の反応速度: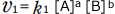 ...①
...①
逆反応の反応速度: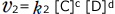 ...②
...②
化学平衡のとき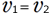 ...③
...③
①、②を③へ代入すると、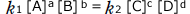
これを整理すると、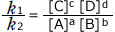 ここで、
ここで、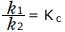 (濃度平衡定数)と置くと
(濃度平衡定数)と置くと
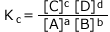 となり、この式を質量作用の法則と呼びます。
となり、この式を質量作用の法則と呼びます。
濃度平衡定数![]() は最も良く使われる平衡定数なので、単に平衡定数という事もあります。
は最も良く使われる平衡定数なので、単に平衡定数という事もあります。
![]() は反応の種類と温度のみで決まる数字で、物質の濃度や触媒の有無によって変化しません。触媒があってもなくても値が変わらないというのは速度定数と違うところですね。
は反応の種類と温度のみで決まる数字で、物質の濃度や触媒の有無によって変化しません。触媒があってもなくても値が変わらないというのは速度定数と違うところですね。
例題をやってみましょう。
問題
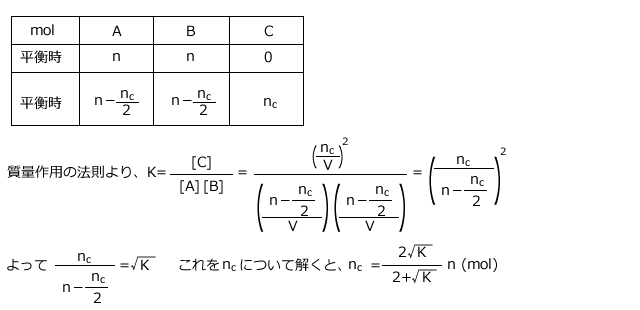
A+B![]() 2Cで表される反応について、V(L)の容器の中にAをn(mol)、Bをn(mol)加えて反応させると、しばらくして平衡に達した。平衡時にCは何mol生じているか。この温度での平衡定数をK(L/mol)とし、温度一定で反応させたものとして答えよ。
2Cで表される反応について、V(L)の容器の中にAをn(mol)、Bをn(mol)加えて反応させると、しばらくして平衡に達した。平衡時にCは何mol生じているか。この温度での平衡定数をK(L/mol)とし、温度一定で反応させたものとして答えよ。
解説
Cが![]() (mol)生じたとします。このとき、平衡前、平衡時の物質量を表にまとめると、見やすく、間違えが少なくなります。
(mol)生じたとします。このとき、平衡前、平衡時の物質量を表にまとめると、見やすく、間違えが少なくなります。
この問題の場合は下表のようになりますね。
問題
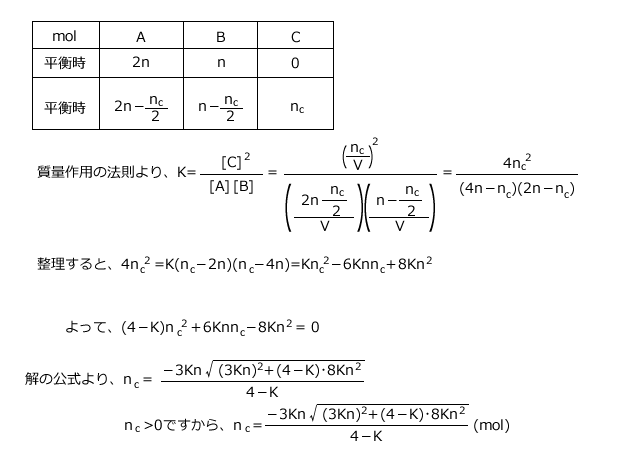
A+B![]() 2Cで表される反応について、V(L)の容器の中にAをn(mol)、Bをn(mol)加えて反応させると、しばらくして平衡に達した。平衡に達した後、Aをさらにn(mol)加えたところ、更に反応が起こって新しい平衡状態に達した。新しい平衡状態でCは何mol生じているか。この温度での平衡定数をK(L/mol)とし、温度一定で反応させたとして答えよ。ただし、K<4とする。
2Cで表される反応について、V(L)の容器の中にAをn(mol)、Bをn(mol)加えて反応させると、しばらくして平衡に達した。平衡に達した後、Aをさらにn(mol)加えたところ、更に反応が起こって新しい平衡状態に達した。新しい平衡状態でCは何mol生じているか。この温度での平衡定数をK(L/mol)とし、温度一定で反応させたとして答えよ。ただし、K<4とする。
解説
このように、反応の途中で物質を加えた場合に到達する平衡は、最初からその物質を加えた時に到達する平衡と同じです。つまり、この問題の場合はAを2n(mol)とBをn(mol)加えて反応させた時に到達する平衡を考えればよいのです。
生じたCを![]() (mol)とします。
(mol)とします。
圧平衡定数
ここまでは平衡時の各成分の濃度の関係に着目してきましたが、気体反応の場合、濃度よりも分圧を使うほうが便利が良く、実際によく用いられます。
そこで、気体反応では濃度平衡定数ではなく、分圧を用いた平衡定数、(圧平衡定数)が使われます。まず、圧平衡定数と濃度平衡定数の関係について説明します。
絶対温度T(K)、容積V(L)、気体定数R(Pa・L/(mol・K))、平衡時の各物質の物質量![]() 、
、![]() 、
、![]() 、
、![]() となる気体反応aA+bB
となる気体反応aA+bB![]() cC+dDを例として説明します。
cC+dDを例として説明します。
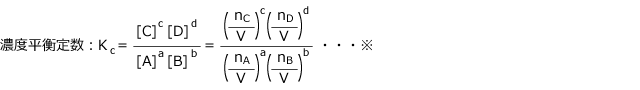
ここで分圧の法則により、Aについて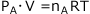 整理すると
整理すると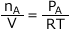 が成立します。また、同様の式がB、C、Dについても成立します。
が成立します。また、同様の式がB、C、Dについても成立します。
それを※に代入すると、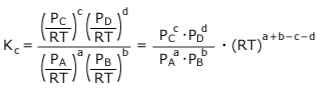
(RT)a+b-c-dを移項すると
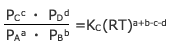 となります。
となります。
ここで、Kc(RT)a+b-c-dは定数なのでこれをkpとおくと分圧を用いた質量作用の法則
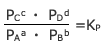 が成立します。
が成立します。
![]() を圧平衡定数といいます。
を圧平衡定数といいます。![]() は反応の種類以外には温度Tのみにしか影響されない値なので、
は反応の種類以外には温度Tのみにしか影響されない値なので、![]() も同様に反応の種類以外にはTのみにしか影響されず、
も同様に反応の種類以外にはTのみにしか影響されず、![]() と同じように使うことができます。
と同じように使うことができます。





















































