理論化学
化学講座 第60回:化学反応速度⑪ 溶解度積
1)溶解度積
塩を水に加えると、その一部が溶け出してイオンになります。しばらくすると、溶解する速度と析出する速度が釣り合って溶解平衡という状態になります。この話は以前、溶解度の所でやりましたね。
今回は、反応速度式を使って溶解平衡の成立している溶液中のイオン濃度について考えます。

溶解速度や析出速度は素反応の反応速度式と同じように表せます。この溶解平衡は AgCl (固) ↔ Ag++Cl- と表せますから、溶解速度は、v1=k1[AgCl (固)]、析出速度は v2=k2[Ag+][Cl-] となります。
溶解平衡のとき、v1=v2 なので、k1[AgCl (固)]=k2[Ag+][Cl-]・ ・ ・ (※) が成立します。
ここで、固体の AgCl の濃度とは、AgCl (固) の単位体積当たりに含まれるモル数のことですから、これは AgCl の固体の量や大きさに関わらず一定ですね。したがって、[AgCl (固)] は常に一定の値です。
そこで、(※) を整理して、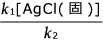 =[Ag+][Cl-] ここで、
=[Ag+][Cl-] ここで、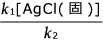 は一定の値なので、この値を Ksp と表すことにします。
は一定の値なので、この値を Ksp と表すことにします。
すると、溶解平衡が成立している時、つまり、飽和水溶液では Ksp=[Ag+][Cl-] が成立します。
ここで、Ksp を AgCl の溶解度積、[Ag+][Cl-] をイオン積といいます。
つまり、「溶解平衡が成立」↔「イオン積=溶解度積が成立」といえます。
ところで、溶解度積は質量作用の法則と同じ考え方なのですから。一般化すると次のようになります。
AmBn ↔ mAα++nBβ- という溶解平衡になっているとき、Ksp=[Aα+]m[Bβ-]n が成立する。
問題
CaCl2 の溶解度積を Ksp として、CaCl2 の飽和水溶液中で成立する溶解度積の式を書きなさい。
解説
CaCl2 ↔ Ca2++2Cl- なので、Ksp[Ca2+][Cl-]2
「AmBn ↔ mAα++nBβ- の溶解平衡が成立」↔「Ksp=[Aα+]m[Bβ-]n が成立 」
という式は、「ある溶液で沈殿が生じるかどうかの判定」と「どれくらいの量の沈殿が生じるかの計算」に用いることができます。
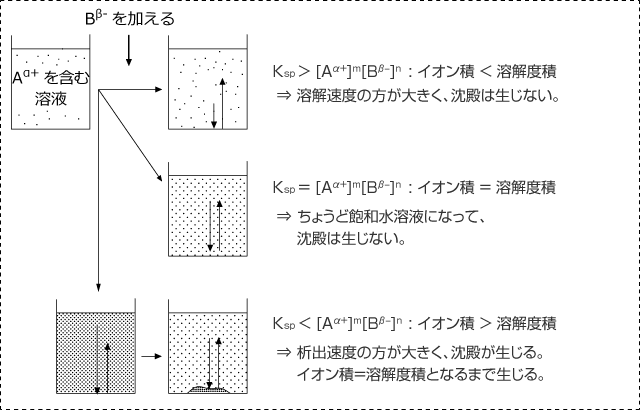
水溶液中である反応が起こって沈殿する可能性のある物質が生じたり、沈殿が生じる可能性のある 2 種類のイオンが混合されたとき、沈殿が実際に生じるかどうかは、沈殿が生じていないと仮定した時のイオン積とその物質の溶解度積の大小を比較すればわかります。
AmBn ↔ mAα++nBβ- の溶解平衡の式 Ksp=[Aα+]m[Bβ-]n の右辺はこの沈殿の析出速度に関係のある値で、左辺は溶解速度に関係のある値です。
ですので、Ksp>[Aα+]m[Bβ-]n のときは、溶解速度の方が析出速度を上回っている状態ですから、この沈殿は析出しません。
また、Ksp=[Aα+]m[Bβ-]n のように、両方が等しい状態のときはちょうどすべて溶解した状態で溶解平衡になっているわけですから、この水溶液は飽和水溶液になっています。ですので、この場合も沈殿は析出しません。
そして、Ksp<[Aα+]m[Bβ-]n のときは、析出速度の方が溶解速度を上回っている状態ですから、沈殿が析出します。
沈殿は水溶液中のイオンが減少して Ksp=[Aα+]m[Bβ-]n が成立するまで生じます。
問題
CuS の溶解度積 Ksp=1.0×10-36 (mol/L)2 とする。[Cu2+]=1.0×10-3 mol/L の水溶液に H2S を加えて徐々に S2- の濃度を上昇させていくと黒色の沈殿が生じた。沈殿が生じた時の [S2-] を求めなさい。
解説
沈殿が生じる瞬間は、Ksp=[Cu2+][S2-] が成立するので 1.0×10-36=1.0×10-3×[S2-] より、[S2-]=1.0×10-33 mol/L
問題
ZnS の溶解度積を Ksp =1.0×10-19 (mol/L)2 とする。[Zn2+]=1.0×10-15 mol/L の水溶液 100 mL に H2S を加えて [S2-]=4.0×10-4 mol/L としたとき、ZnS は何 g 生じるか求めなさい。ZnS=97 とし、H2S の溶解による水溶液の体積変化は無視できるものとする。
解説
まず、沈殿が生じるかどうかを確かめましょう。
沈殿が生じていないとしてイオン積を取ると、[Zn2+][S2-]=4.0×10-19>Ksp なので、ZnS は沈殿します。
ここで、ZnS の沈殿が生じた結果、x mol/L の濃度低下が起こったとします。
すると、[Zn2+][S2-]=(1.0×10-15-x)×4.0×10-4=1.0×10-19 が成立しますね。
これを解くと、x=1.0×10-15-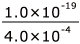 =0.75×10-15 mol/L となりますから、つまり、ここで生じた沈殿は、0.75×10-15 mol/L で 100 mL 分と言うことになります。
=0.75×10-15 mol/L となりますから、つまり、ここで生じた沈殿は、0.75×10-15 mol/L で 100 mL 分と言うことになります。
即ち、生じた沈殿は、0.75×10-15×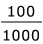 ×97=7.275×10-15 ≒ 7.3×10-15 g です。
×97=7.275×10-15 ≒ 7.3×10-15 g です。
問題
CuS の溶解度積を Ksp=1.0×10-36 (mol/L)2、ZnS の溶解度積を Ksp=1.0×10-19 (mol/L)2 とする。
[Zn2+]=0.10 mol/L、[Cu2+]=0.10 mol/L の水溶液に H2S を溶かし、CuS のみを沈殿させたい時、[S2-] はどのような値の範囲にすればよいか。
解説
CuS が沈殿し始める時の [S2-] を x mol/L、ZnS が沈殿し始める時の [S2-] を y mol/L とします。
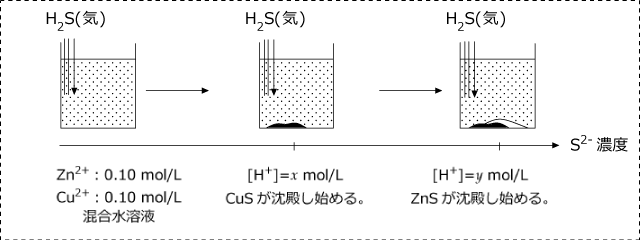
すると、[Cu2+][S2-]=0.1 × x=1.0×10-36 より、x=1.0×10-35 mol/L
[Zn2+][S2-]=0.1 × y=1.0×10-19 より、y=1.0×10-18 mol/L が成立します。
よって、[S2-] の取るべき値の範囲は、1.0×10-35<[S2-]1.0×10-18 mol/L
2)溶解度積の応用:沈殿滴定
水溶液中に含まれるイオンの濃度を、沈殿の生成を利用して求める手法を沈殿滴定と言います。ここでは代表的な沈殿滴定の方法であるモール法について解説します。
モール法は、水溶液中の Cl- の濃度を Ag+ を用いて滴定する方法で、指示薬として CrO42- を用います。
手順は、Cl- の含まれた水溶液に CrO42- を少量加えたのち、AgNO3 を滴下します。すると、溶解度積の小さな AgCl が先に沈殿しはじめます。
更に AgNO3 を加えてしばらくすると、赤色の Ag2CrO4 が表面に沈殿し、白色の AgCl の表面が薄く赤色になります。この瞬間を滴定の当量点とします。
そして、ここまでに加えた「Ag+ の物質量 」=「Cl- の物質量 」が成立しますので、この式からもともと水溶液中に含まれていた Cl- の物質量や濃度を求めることができます。こんな式、本当に成立するの?という疑問があると思いますが、それは後で解説します。
問題
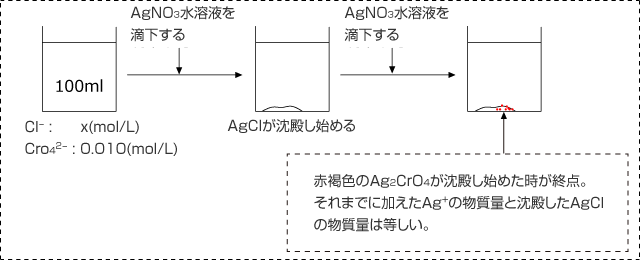
Cl- が含まれているが、濃度のわからない水溶液 100 mL がある。
ここに KCrO4 を加えて [CrO42-] =0.010 mol/L とした。さらに、1.0×10-10 mol/L の AgNO3 水溶液を滴下すると白色の AgCl が沈殿し始めた。更に滴下すると赤褐色の Ag2CrO4 が沈殿し始めたので滴定をやめた。滴下した AgNO3 は全部で 3.0 mL であった。
このことから、もとの水溶液に含まれていた Cl- の濃度を求めよ。
解説
元の水溶液の Cl- の濃度を x mol/L とする。
沈殿滴定では「元の水溶液に含まれていた Cl- の物質量」=「滴下した Ag+ の物質量」の式が成立するから。
x ×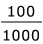 =1.0×10-10×
=1.0×10-10×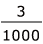 よって、x =3.0×10-12 mol/L
よって、x =3.0×10-12 mol/L
最後に、「元の水溶液に含まれていた Cl- の物質量」=「滴下した Ag+ の物質量」の式が成立することを説明します。Ag2CrO4 が沈殿し始めた時、水溶液中にはまだ Cl- が残っています。加えた Ag+ も、水溶液中に Ag+ として残っているもの、AgCl として沈殿しているもの、Ag2CrO4 として沈殿しているものの 3 通りに分かれます。
もともと水溶液中に存在していた Cl- の物質量と、滴下した Ag+ の物質量が等し事を示すためには、下の ① と ②が成立することを示す必要があります。
沈殿滴定が成立する条件
① 存在する Cl- の物質量と、生成した AgCl の物質量がほぼ等しい。
② 滴下した Ag+ の物質量と、生成した AgCl の物質量がほぼ等しい。
Ag+ の滴下量と Cl- の滴下量がほぼ等しい。
このことを示すためにどうしたらよいのか、図を描いて考えてみましょう。ちょうど下図のようになります。
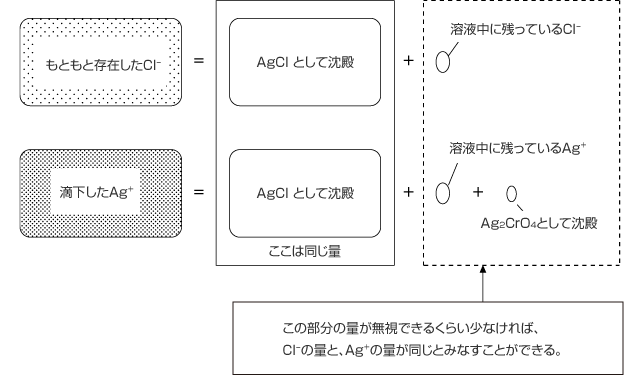
溶液中に残っている Cl-、溶液中に残っている Ag+、沈殿した Ag2CrO4 、この 3 つの量について考えればいいですね。具体的には、次の 3 点について考えます。
- 1)もともと存在した Cl- の量に対して、溶液中に残っている Cl- の量は無視できるか。
- 2)滴下した Ag+ の量に対して、溶液中に残っている Ag+ の量は無視できるか。
- 3)滴下した Ag+ の量に対して、沈殿した Ag2CrO4 の量は無視できるか。
うっすらと赤色になる程度なら Ag2CrO4 の量は無視できます。ですので、問題は1)と2)になります。
文字では説明が難しいので、具体的な例として、Cl- 濃度が 0.010 mol/L の水溶液に CrO42- 濃度が 0.010 mol/L となるように K2CrO4 を加えた水溶液に、AgNO3 水溶液を滴下した場合を考えましょう。
簡単にするため、AgNO3 水溶液を加えたことによる溶液の体積変化は無視することにします。
AgCl と Ag2CrO4 の溶解度積は KspAgCl=1.0×10-10 (mol/L)2、KspAg2CrO4=1.0×10-12 (mol/L)3 とします。
Ag2CrO4 が沈殿し始めた時の Ag+ の濃度を求めます。
溶解度積より、[Ag+]2[CrO42-]=[Ag+]2×0.010=1.0×10-12 となりますので、[Ag+]=1.0×10-5 mol/L となります。
このとき、AgCl の溶解度積から、Cl- の濃度は、溶解度積より [Ag+][Cl-]=1.0×10-5×[Cl-]=1.0×10-10 を満たしますので、[Cl-]=1.0×10-5 mol/L となります。
まず、1)について。もともと存在した Cl- の量に対して、溶液中に残っている Cl- の量は無視できるか。について考えてみましょう。溶液の体積は変化していないので、濃度を比較比較します。
もともとの濃度が 0.010 mol/L、Ag2CrO4 が沈殿し始めた時の濃度が 1.0×10-5 mol/L なので、沈殿せずに残っている Cl- は、もともと存在した Cl- の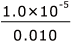 ×100=0.10% となります。よって、1)は十分言えますね。
×100=0.10% となります。よって、1)は十分言えますね。
次に、2)滴下した Ag+ の量に対して溶液中に残っている Ag+ の量は無視できるかについても考えてみましょう。
こちらも体積が変化していないので濃度で考えます。
1)が言えたことから、沈殿した AgCl は、水溶液濃度で、0.010 mol/L 分、と言うことになります。
残っている Ag+ が 1.0×10-5 mol/L ですから、沈殿せずに水溶液中に残っている Ag+ は、滴下量の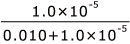 ×100 ≒ 0.10% となり、こちらも、1)と同様に十分小さな値で無視できるといえます。
×100 ≒ 0.10% となり、こちらも、1)と同様に十分小さな値で無視できるといえます。
以上より、この水溶液ではモール法を利用することが妥当だと言えます。





















































