理論化学
化学講座 第23回:酸化と還元⑤
前回、過マンガン酸滴定について説明しましたが、過マンガン酸滴定は、過マンガン酸カリウムが酸化剤なので還元剤の濃度しか測定することができません。
濃度未知の酸化剤の濃度を求めるには、還元剤であるヨウ化物イオンを用いた滴定を行います。
ヨウ素滴定の理論
ヨウ素滴定は一種の逆滴定です。酸化剤とヨウ化物イオンを反応させて、遊離したヨウ素を、デンプンを指示薬として還元剤のチオ硫酸ナトリウムで滴定することにより、酸化剤の物質量を測定します。
濃度未知の H2O2 水溶液の濃度を、この方法で求めることを考えてみましょう。まず、v mℓ、
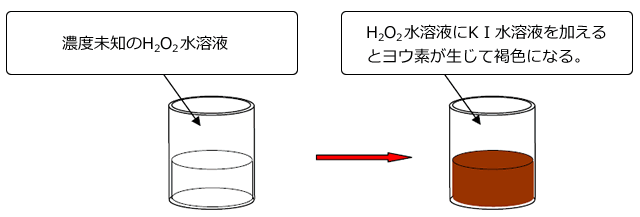
χ mol/ℓ の H2O2 水溶液をビーカーに量り取り、ここに、過剰量の KI 水溶液を加えます。
KI 水溶液には還元剤として働くⅠ-が含まれていますから、H2O2 はⅠ-と次の①、②式のように反応してI2が生じます。このとき、小さなI2の結晶が生じるため、溶液は褐色ににごります。
- 半反応式
-
H2O2 + 2H+ + 2e- → 2H2O ・・・・ ① (酸化剤) 2Ⅰ- → Ⅰ2 + 2e- ・・・・ ② (還元剤)
酸化剤の半反応式を見てみると、1mol の H2O2 は 2mol の e- を受け取ります。また、1mol の I2 が生じる際には 2mol の e- が放出されますね。したがって、1mol の H2O2 から 1mol の I2 が生じます。従って、反応したHO2と、生じたI2の物質量は同じになります。
反応した H2O2 = 発生した I2 =χ × ![]() mol
mol
次に、酸化剤である I2 の物質量を還元剤で滴定すれば、濃度未知の H2O2 水溶液に含まれる H2O2 の物質量を知ることができますね。滴定の還元剤にはチオ硫酸ナトリウム (Na2S2O3) 水溶液、指示薬にはデンプンを用います。
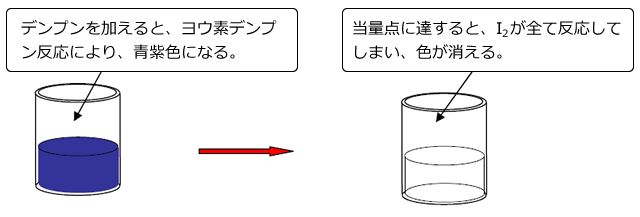
デンプンは I2 が存在するとヨウ素デンプン反応によって青紫色になります。Na2S2O3 水溶液による滴定の終点は、この青紫色が消えたときです。
この滴定における半反応式は次の2式です。
- 半反応式
-
Ⅰ2 + 2e- → 2Ⅰ- ・・・・ ③ 2S2O3 2- → S4O6 2- + 2e- ・・・・ ④
この反応式から、1mol の I2と 2mol の S2O32-が反応することが分かりますね。
滴定に用いた Na2S2O3 水溶液の濃度を c mol/ℓ、終点までの滴下量を v1 mℓ とすると、次の式が成立します。
反応した I2 : 反応した S2O32- = χ × ![]() mol : c ×
mol : c × ![]() = 1:2
= 1:2
これをχについて解くと、![]() = mol/ℓ となり、最初の H2O2水溶液の濃度が分かりますね。
= mol/ℓ となり、最初の H2O2水溶液の濃度が分かりますね。





















































