理論化学
化学講座 第25回:電池①(ボルタの電池とダニエル電池)
イオン化傾向とは、金属が電子を押し付ける力の大きさですから、電解質水溶液中でイオン化傾向の異なる2 種類の金属を接触させると、イオン化傾向の大きな金属から小さな金属に向かって電子が移動します。
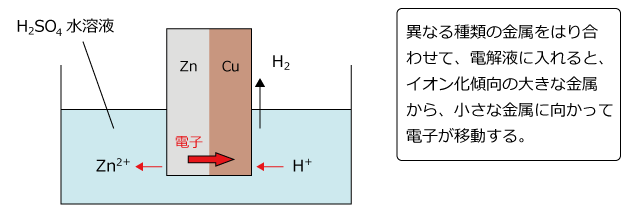
例えば、図のように Zn と Cu を希硫酸中で接触させると、イオン化傾向の大きな Zn からイオン化傾向の小さな Cu に電子が移動し、Zn は Zn2+ になって溶け出します。Cu 板に流れ込んだ電子は水溶液中の H+ に受け取られ、その結果、Cu 板上には H2 が発生します。
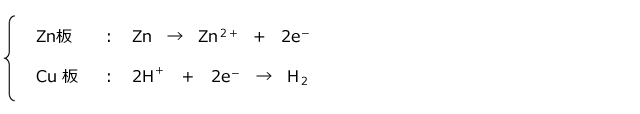
さて、このように電解質水溶液中で2種類の金属板を接触させると、電流が流れます。
しかし、このままではこの電流を取り出すことはできませんね。単に2種類の金属が接触しているところで電子がやり取りされているだけです。
そこで、電子をとりだすために、Zn板とCu 板を離して、導線でつなぎます。
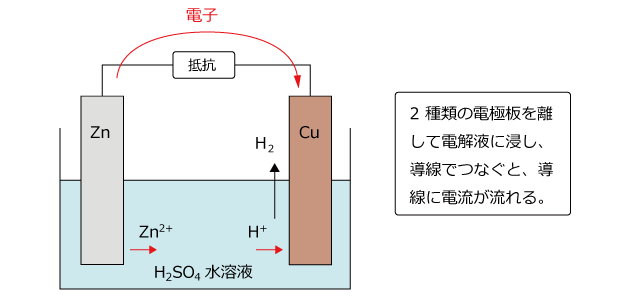
すると、図のように導線を通ってZn板からCu板に向かって電子が移動するので、電流を取り出すことができるようになります。
このように化学反応によって電流を取り出す装置(化学エネルギーを電気エネルギーに変換する装置)を電池といい、電子を放出する金属を負極板、電子を受け取る金属を正極板、極板を浸している液を電解液といいます。
負極では電子を放出する反応が起こりますから酸化反応が、正極では電子を受け取る反応が起こりますから、還元反応がそれぞれ起こります。
また、負極|電解液|正極 の順で書いたものを電池式と言い、電池を表すのに用います。この電池を表す電池式は、Zn|H2SO4 aq|Cu となります。
●ボルタの電池( Zn|H2SO4 aq|Cu )
先ほど紹介した負極板が Zn 、正極版が Cu 、電解液が H2SO4 水溶液の電池をボルタの電池といい、1800 年にフランスのボルタが発明し、ナポレオン1世に献上したものと言われています。
ボルタの電池の起電力は 1.1V ですが、大きな欠陥のある電池でした。
ボルタの電池は放電を始めるとすぐに電圧が 0.1~0.3V まで低下してしまいまうのです。これは、Cu 板上に H2 の気体が生じるために起こる現象で、電池の分極と呼ばれています。
ボルタの電池

分極は、正極板上に生じる水素の気泡が原因ですから、分極が起こるのを防ぐには、正極付近に酸化剤( H2O2 水溶液など)を加えて、発生した水素を酸化して H2O にしてしまいます。すると、Cu 板上の水素の気泡が消えて起電力が回復します。このような目的で加える酸化剤を、減極剤といいます。





















































