理論化学
化学講座 第33回:熱化学方程式③【熱化学方程式の解き方】
この原理を使って、次の例題を解いてみましょう。
例題) 次の熱化学方程式を利用して、C2H5OH(液)の生成熱を求めよ。
C(黒鉛) + O2(気) = CO2(気) + 394KJ・・・・①
H2(気) + ![]() O2(気) = H2O(液) + 286KJ・・・・②
O2(気) = H2O(液) + 286KJ・・・・②
C2H5OH(液) + 3O2(気) = 2CO2(気) + 3H2O(液) + 1370KJ・・・・③
解説・解答)
まず、求めたい熱をQKJ/molとしてQを含む熱化学方程式を書きます。
今回求めたいのはエタノールの生成熱です。生成熱は、物質1molが単体から生じるときに放出する熱量ですから、熱化学方程式は下式のように表せます。
2C(黒鉛) + 3H2(気) + ![]() O2(気) = C2H5OH(液) + QKJ・・・・④
O2(気) = C2H5OH(液) + QKJ・・・・④
次に、①~④の熱量をエネルギー図に描きます。手順は、次の通りです。
●エネルギー図の描き方のポイント
エネルギーが大きいものほど不安定ですから、不安定なものほど上の方に、安定なものほど下に書きます。具体的には、原子>単体>化合物>H2O、CO2の順にエネルギーが小さくなります。酸素原子なんて、周りにあまり存在しませんよね。酸素分子ばかりです。これは、原子が不安定なためです。
つぎに、基準を取ります。条件として燃焼熱が与えられている時はH2OとCO2を下の基準に、生成熱が与えられているときは単体を上の基準に結合エネルギーが与えられているときは原子を上の基準にします。
Qを含む部分を最初に書き、そこに他の反応式を加えていく。このとき、燃焼熱であれば、Q含む式に出てくる化合物を両方とも完全燃焼させると簡単にエネルギー図が書けます。
では、この手順に従ってエネルギー図を描いてみます。まず、Qを含む部分を先に描きます。
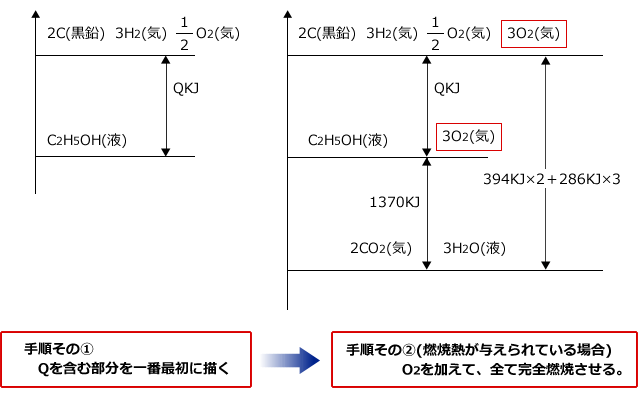
ヘスの法則より、2×394 + 3×286 = 1370 + Q
これを解くと、Q = 276 KJです。よって、エタノールの生成熱は276KJ/molです。
エネルギー図を用いた解法は、図を描くのに慣れないとなかなか難しいですが、この解法でないと溶けなかったり、解くのに非常に時間のかかる問題もありますから、頑張って解き方を覚えてください。
次は、同じ問題を代数的解法、つまり、ふつうの方程式の解き方で解いてみましょう。熱化学方程式も方程式である事に違いは無いのですから、うまく変形すれば連立方程式の解き方でQを求める事ができます。センターレベルの問題なら、エネルギー図を用いるより、こちらのほうが速く解けます。